题目内容
16.绿色化学的核心,是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期望的产品中,下列过程不符合这一思想的是( )| A. | 乙烯合成聚乙烯 | |
| B. | 烯烃与水煤气发生羰基合成反应RCH=CH2+H2+CO$\stackrel{催化剂}{→}$RCH2CH2CHO | |
| C. | 甲烷、CO合成乙酸乙酯2CH4+2CO$\stackrel{催化剂}{→}$CH3COOCH2CH3 | |
| D. | 实验室用乙醇制乙烯 |
分析 根据“绿色化学”的特征:反应物中原子全部转化为欲制得的产物,即原子的利用率为100%,即生成物质只有一种.
解答 解:反应物全部转化为最终产物,生成物只有一种.即原子利用率为100%,
A、乙烯合成聚乙烯,产物只有一种,即原子的利用率为100%,符合“绿色化学”的思想,故A符合;
B、RCH=CH2+H2+CO$\stackrel{催化剂}{→}$RCH2CH2CHO,此反应中三种物质生成一种,符合“绿色化学”的思想,故B符合;
C、2CH4+2CO$\stackrel{催化剂}{→}$CH3COOCH2CH3,产物只有一种,故符合“绿色化学”的思想,故C符合;
D、实验室利用乙醇制取乙烯,乙醇发生消去反应生成乙烯和水,有两种产物,不符合“绿色化学”的思想,故D不符合;
故选D.
点评 本题考查绿色化学,难度不大.要抓住绿色化学的特征:原子利用率为100%,产物只有一种.

练习册系列答案
相关题目
6.全部属于纯净物的组合是( )
| A. | 福尔马林、白酒、食醋 | B. | 汽油、油脂、酚醛树脂 | ||
| C. | 石炭酸、盐酸、冰醋酸 | D. | 甘油、乙醇钠、氯仿 |
7.常温下,下列有关叙述正确的是( )
| A. | 饱和氯水中滴加NaOH至溶液呈中性:c(Na+)═2c(ClO-)+c(HClO) | |
| B. | 100ml 0.2mol/L的NH4Cl溶液和200ml 0.1mol/L的NH4Cl溶液所含有的n(NH4+)相同 | |
| C. | pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)≥c(H+) | |
| D. | 常温下,pH=4.75、浓度均为0.1mol/L的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
11.下列各组物质中,一定属于同系物的是( )
| A. | C2H4和C4H8 | B. | 苯和甲苯 | C. | 乙二醇和丙三醇 | D. |  和 和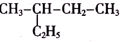 |
1.近期我国中东部地区连续多日出现阴霾均系环境污染造成的,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的.下列环境问题与所对应的物质不相关的是( )
| A. | 温室效应--CO2 | B. | 光化学污染--NO2 | C. | 酸雨--SO2 | D. | 臭氧层破坏--CO |
8.《化学教育》报道了数起因食用有“瘦肉精”的猪肉和内脏,而发生急性中毒的恶性事件.这足以说明,“瘦肉精”变成了“害人精”.“瘦肉精”的结构可表示为:
下列说法正确的是( )

下列说法正确的是( )
| A. | 摩尔质量为313.5 g | B. | 属于芳香烃 | ||
| C. | 分子式为C12H19Cl3N20 | D. | 消去产物有2种 |
5.下表为部分短周期元素化合价及相应氢化物沸点的数据:
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第三周期元素的是ACEG(用表中元素编号填写).写出H的最高价氧化物的结构式:O=C=O.
(2)比较A、D、G三种简单阴离子的半径大小:r(S2-)>r(Cl-)>r(O2-).比较元素F、G的氢化物的沸点高低,并说明理由F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高.(均用实际的元素符号表示)
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(5)以下说法正确的是bc(填编号).
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现.
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第三周期元素的是ACEG(用表中元素编号填写).写出H的最高价氧化物的结构式:O=C=O.
(2)比较A、D、G三种简单阴离子的半径大小:r(S2-)>r(Cl-)>r(O2-).比较元素F、G的氢化物的沸点高低,并说明理由F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高.(均用实际的元素符号表示)
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(5)以下说法正确的是bc(填编号).
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现.