题目内容
6.某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物.某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了如图1探究:请回答下列问题:
Ⅰ.(1)实验时用10mol•L-1的浓硫酸配制100mL 1mol•L-1 H2SO4溶液,所需浓硫酸的体积为10.0mL.
(2)容量瓶所具备的功能是A(填序号).
A.配制一定体积准确浓度的溶液 B.长期贮存溶液
C.常用来代替量筒量取一定体积的液体 D.用来溶解固体溶质
(3)在如图2配制过程示意图中,错误的有(填序号)①④.
(4)下列说法正确的是AC.
A.洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差
B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
Ⅱ.(1)步骤 ③中产生的红褐色物质是(填化学式)Fe(OH)3.
(2)从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:
a.过滤,b.洗涤,c.灼烧,d.冷却
(3)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为0.19ag.

分析 Ⅰ.(1)根据浓硫酸在稀释前后,溶质的物质的量保持不变进行计算;
(2)容量瓶是配制一定体积准确浓度的标准溶液的定容仪器;
(3)稀释浓硫酸时是将浓硫酸倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散;读数时应平视;
(4)根据公式c=$\frac{n}{V}$,可以根据影响n和V的因素来分析回答;
Ⅱ.由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量,
(1)步骤③是将Fe3+转化为氢氧化铁沉淀;
(2)由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(3)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.
解答 解:Ⅰ.(1)浓硫酸在稀释前后,溶质的物质的量保持不变,设所需浓硫酸最小体积为V,则100mL×10-3×1mol/L=10mol/L×V,解得V=10.0mL,
故答案为:10.0mL;
(2)容量瓶作为精密仪器不可用于储存和溶解,也不能测量除其规格以外容积的液体体积,
故答案为:A;
(3)稀释浓硫酸时是将浓硫酸沿器壁倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散;读数时应平视,不能仰视和俯视,
故答案为:①④;
(4)A.洗涤烧杯2~3次,并将洗涤液移入容量瓶,否则浓度偏小,故A正确;
B.未冷却体积偏小,浓度偏大,故B错误;
C.定容时仰视,体积偏大,浓度偏小,故C正确;
故答案为:AC;
Ⅱ.(1)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,则该红褐色物质为Fe(OH)3,
故答案为:Fe(OH)3;
(2)由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;
(3)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量:$\frac{ag×\frac{112}{160}}{10}$=0.07ag,含硫酸亚铁的质量为:$\frac{0.07a}{\frac{56}{152}}$=0.19ag,
故答案为:0.19a.
点评 本题考查学生对物质的量浓度溶液的配制实验原理与实验操作的理解、化学计算等知识,题目难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 乙烯合成聚乙烯 | |
| B. | 烯烃与水煤气发生羰基合成反应RCH=CH2+H2+CO$\stackrel{催化剂}{→}$RCH2CH2CHO | |
| C. | 甲烷、CO合成乙酸乙酯2CH4+2CO$\stackrel{催化剂}{→}$CH3COOCH2CH3 | |
| D. | 实验室用乙醇制乙烯 |
| A. | 元素的化学性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素周期律的实质是因为元素原子最外层电子数由1→8周期性变化而引起的 | |
| C. | 半径由大到小、氧化性由弱到强的是K+、Mg2+、Al3+、H+,而还原性由弱到强的则是I-、Br-、Cl-、F- | |
| D. | 某元素R的最高价氧化物化学式为R2O5,又知R的气态氢化物中含氢的质量分数为8.8%,则R的相对原子质量为28 |
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 原溶液中有Na+,无K+ |
| B | 向醋酸钠溶液中滴入酚酞试液,加热后若红色加深 | 证明盐类的水解是吸热反应 |
| C | 向CH2=CHCHO中滴入KMnO4酸性溶液,紫红色褪去 | 证明CH2=CHCHO中含有碳碳双键 |
| D | 硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 证明非金属性:Cl>Si |
| A. | A | B. | B | C. | C | D. | D |
①电解池是将化学能转变成电能的装置
②金属和石墨导电均为物理变化,电解质溶液导电是学变化
③不能自发进行的氧化还原反应,通过电解的原理有可能实现
④将铜锌原电池用含KCl的盐桥相连时,盐桥中的Cl-会移向正极区
⑤利用电化学原理保护金属主要有两种方法,分别是牺牲阳极的阴极保护法和外加直流电的阴极保护法.
| A. | ①②③④ | B. | ④ | C. | ①④⑤ | D. | ②③⑤ |
| A. | ${\;}_{77}^{191}$Ir的质子数为191 | |
| B. | ${\;}_{77}^{191}$Ir和${\;}_{77}^{193}$Ir互为同位素 | |
| C. | ${\;}_{77}^{191}$Ir和${\;}_{77}^{193}$Ir的中子数相同 | |
| D. | ${\;}_{77}^{193}$Ir的核外电子数为116 |
| A. | 12C和14C | B. | O2和O3 | ||
| C. | CH3CH2OH和CH3OCH3 | D. | 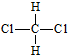 和 和 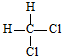 |
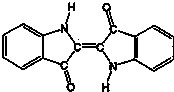
| A. | 该物质是高分子化合物 | B. | 它的分子式是C15H10N2O2 | ||
| C. | 靛蓝由碳、氢、氧、氮四种元素组成 | D. | 它是不饱和的有机物 |
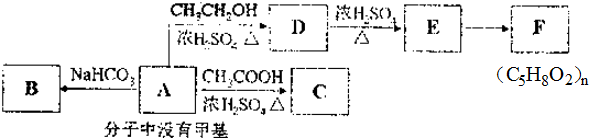
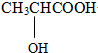 .
.