题目内容
4.从H+、K+、Cu2+、Cl-、SO42-中选取适当的离子组成符合下列情况的电解质,进行电解(阳离子只能使用一次).(1)以碳棒为电极进行电解,电解质的物质的量减少,水的物质的量保持不变,两极都有气体生成,气体体积相同,则该电解质的化学式为HCl,电解的阴极反应2H++2e-=H2↑,电解的阳极反应2Cl--2e-=Cl2↑,电解的总方程式是2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑.
(2)以铂丝为电极进行电解,水的物质的量减少,电解质的物质的量保持不变,两极都有气体生成,气体体积比为2:1,则该电解质的化学式为K2SO4,阴极反应式为4H++4e-=2H2↑,阳极反应式为4OH--4e-=2H2O+O2↑.
(3)惰性电解,电解质的物质的量减少,水的物质的量也减少,pH下降,则电解质的化学式为CuSO4,电解的总方程式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4.
分析 这几种离子的水溶液中离子放电顺序分别为:Cl->OH->SO42-、Cu2+>H+>K+;
(1)以碳棒为电极进行电解,电解质的物质的量减少,水的物质的量保持不变,说明电解过程中电解质放电,两极都有气体生成,气体体积相同,说明阴阳离子生成每个气体分子转移电子相等,阴极上只能是氢离子放电、则阳极上氯离子放电,所以该电解质的化学式为HCl;
(2)以铂丝为电极进行电解,水的物质的量减少,电解质的物质的量保持不变,两极都有气体生成,气体体积比为2:1,说明溶液中氢离子、氢氧根离子放电,则溶液中阳离子为钾离子、阴离子为硫酸根离子,所以该电解质的化学式K2SO4;
(3)惰性电解,电解质的物质的量减少,水的物质的量也减少,pH下降,说明阳极上氢氧根离子放电、阴极上金属离子放电,电解过程中生成酸,所以电解质为CuSO4.
解答 解:这几种离子的水溶液中离子放电顺序分别为:Cl->OH->SO42-、Cu2+>H+>K+;
(1)以碳棒为电极进行电解,电解质的物质的量减少,水的物质的量保持不变,说明电解过程中电解质放电,两极都有气体生成,气体体积相同,说明阴阳离子生成每个气体分子转移电子相等,阴极上只能是氢离子放电、则阳极上氯离子放电,所以该电解质的化学式为HCl,阴极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑;阳极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑;电池反应式为2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑,
故答案为:HCl;2H++2e-=H2↑;2Cl--2e-=Cl2↑; 2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑;
(2)以铂丝为电极进行电解,水的物质的量减少,电解质的物质的量保持不变,两极都有气体生成,气体体积比为2:1,说明溶液中氢离子、氢氧根离子放电,则溶液中阳离子为钾离子、阴离子为硫酸根离子,所以该电解质的化学式K2SO4;阴极上氢离子得电子生成氢气,电极反应式为4H++4e-=2H2↑;阳极上氢氧根离子放电生成氧气,阳极反应式为4OH--4e-=2H2O+O2↑;
故答案为:K2SO4;4H++4e-=2H2↑;4OH--4e-=2H2O+O2↑;
(3)惰性电解,电解质的物质的量减少,水的物质的量也减少,pH下降,说明阳极上氢氧根离子放电、阴极上金属离子放电,电解过程中生成酸,所以电解质为CuSO4,电池反应式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,
故答案为:CuSO4;2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4.
点评 本题考查电解原理,为高频考点,明确离子放电顺序是解本题关键,根据阴阳极上得到的物质及其物质的量之比确定溶液中的溶质,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 气体的平均相对分子质量不再改变 | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | 单位时间内生成3n mol X,同时生成n mol Y |
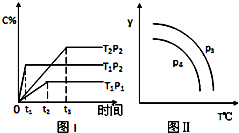 在某容积一定的密闭容器中,有下列可逆反应xA(g)+B(g)?2C(g),反应曲线(T表示温度,P表示压强,C% 表示C的体积分数)如图所示,试判断对图的说法中一定正确的是( )
在某容积一定的密闭容器中,有下列可逆反应xA(g)+B(g)?2C(g),反应曲线(T表示温度,P表示压强,C% 表示C的体积分数)如图所示,试判断对图的说法中一定正确的是( )| A. | 该反应是吸热反应 | |
| B. | x=2 | |
| C. | P3<P4,y轴可表示混合气体的相对分子质量 | |
| D. | P3>P4,y轴可表示C物质在平衡体积中的百分含量 |
| A. | 乙烯合成聚乙烯 | |
| B. | 烯烃与水煤气发生羰基合成反应RCH=CH2+H2+CO$\stackrel{催化剂}{→}$RCH2CH2CHO | |
| C. | 甲烷、CO合成乙酸乙酯2CH4+2CO$\stackrel{催化剂}{→}$CH3COOCH2CH3 | |
| D. | 实验室用乙醇制乙烯 |
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 原溶液中有Na+,无K+ |
| B | 向醋酸钠溶液中滴入酚酞试液,加热后若红色加深 | 证明盐类的水解是吸热反应 |
| C | 向CH2=CHCHO中滴入KMnO4酸性溶液,紫红色褪去 | 证明CH2=CHCHO中含有碳碳双键 |
| D | 硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 证明非金属性:Cl>Si |
| A. | A | B. | B | C. | C | D. | D |
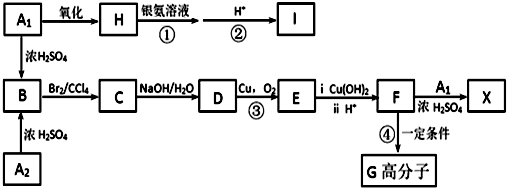
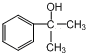 X
X
 ;③2
;③2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2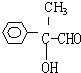 +2H2O
+2H2O .
.