题目内容
5.下表为部分短周期元素化合价及相应氢化物沸点的数据:| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第三周期元素的是ACEG(用表中元素编号填写).写出H的最高价氧化物的结构式:O=C=O.
(2)比较A、D、G三种简单阴离子的半径大小:r(S2-)>r(Cl-)>r(O2-).比较元素F、G的氢化物的沸点高低,并说明理由F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高.(均用实际的元素符号表示)
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(5)以下说法正确的是bc(填编号).
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现.
分析 短周期元素中,A、D均有最低价-2,处于ⅥA族,D氢化物沸点较高,故A为S元素、D为O元素;B、E均有最高价+5、最低价-3,处于VA族,B元素氢化物沸点较大,故B为N元素、E为P元素;C、H均有最高价+4、最低价-4,处于ⅣA族,且C元素氢化物沸点较高,故H为碳元素、C为Si;F、G均有最低价-1价,且G有最高价+7,原子半径也大于E,故F为F元素、G为Cl,据此解答.
解答 解:短周期元素中,A、D均有最低价-2,处于ⅥA族,D氢化物沸点较高,故A为S元素、D为O元素;B、E均有最高价+5、最低价-3,处于VA族,B元素氢化物沸点较大,故B为N元素、E为P元素;C、H均有最高价+4、最低价-4,处于ⅣA族,且C元素氢化物沸点较高,故H为碳元素、C为Si;F、G均有最低价-1价,且G有最高价+7,原子半径也大于E,故F为F元素、G为Cl.
(1)S、Si、P、Cl属于第三周期元素,H的最高价氧化物为CO2,结构式:O=C=O
故答案为:ACEG;O=C=O;
(2)A、D、G三种简单阴离子分别为S2-、O2-、Cl-,电子层结构相同的离子,核电荷数越多离子半径越小,离子电子层越多,离子半径越大,故离子半径:r(S2-)>r(Cl-)>r(O2-);
F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高,
故答案为:r(S2-)>r(Cl-)>r(O2-);F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高;
(3)由表中O元素和氢元素的原子按1:1组成的常见液态化合物为H2O2,H2O2具有强氧化性、还原性,可以氧化Na2SO3,能被KMnO4氧化,H2O2的稀溶液易被MnO2、FeCl3 催化分解,
故答案为:ab;
(4)SOCl2在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸,则生成SO2与HCl,该反应的化学方程式是SOCl2+H2O=SO2↑+2HCl,
故答案为:SOCl2+H2O=SO2↑+2HCl;
(5)a.由于键长Si-Si键>C-C键,故C-C键更稳定性,则晶体硅的沸点低于金刚石,氢化物均为分子晶体,SiH4的相对分子质量大于CH4的,SiH4分子之间作用力更强,沸点更高,二氧化硅属于原子晶体,二氧化碳属于分子晶体,故二氧化硅的沸点更高,故a错误;
b.工业上利用焦炭与二氧化硅反应得到粗硅,再利用硅与氯气发生反应生成四氯化硅、四氯化硅被氢气还原得到硅,进行粗硅的提纯;Si可以与强碱、氢氟酸,故b正确;
c.把氧气通入到硫化氢的水溶液中反应生成S与水,可以说明氧元素非金属性比硫的强,故c正确,
故选:bc.
点评 本题考查性质结构位置关系应用,关键是利用化合价、氢化物沸点推断元素,注意对基础知识的理解掌握.

 阅读快车系列答案
阅读快车系列答案| A. | 气体的平均相对分子质量不再改变 | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | 单位时间内生成3n mol X,同时生成n mol Y |
| A. | 乙烯合成聚乙烯 | |
| B. | 烯烃与水煤气发生羰基合成反应RCH=CH2+H2+CO$\stackrel{催化剂}{→}$RCH2CH2CHO | |
| C. | 甲烷、CO合成乙酸乙酯2CH4+2CO$\stackrel{催化剂}{→}$CH3COOCH2CH3 | |
| D. | 实验室用乙醇制乙烯 |
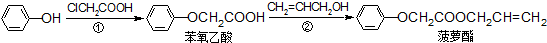
| A. | 步骤①产物中残留的苯酚可用FeCl3溶液检验 | |
| B. | 步骤②产物中残留的CH2=CHCH2OH可用溴水检验 | |
| C. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 | |
| D. | 苯氧乙酸和菠萝酯均可与H2在一定条件下发生反应 |
 可逆反应X2(g)+3Y2(g)═2Z2(g)在一密闭容器中进行,如图是该过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
可逆反应X2(g)+3Y2(g)═2Z2(g)在一密闭容器中进行,如图是该过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t2-t3,各物质的浓度不再发生变化 | |
| B. | t3时刻改变温度,该反应限度不会改变 | |
| C. | t2-t3,反应不再发生 | |
| D. | t1时,反应只向正方向进行 |
| A. | 元素的化学性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素周期律的实质是因为元素原子最外层电子数由1→8周期性变化而引起的 | |
| C. | 半径由大到小、氧化性由弱到强的是K+、Mg2+、Al3+、H+,而还原性由弱到强的则是I-、Br-、Cl-、F- | |
| D. | 某元素R的最高价氧化物化学式为R2O5,又知R的气态氢化物中含氢的质量分数为8.8%,则R的相对原子质量为28 |
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 原溶液中有Na+,无K+ |
| B | 向醋酸钠溶液中滴入酚酞试液,加热后若红色加深 | 证明盐类的水解是吸热反应 |
| C | 向CH2=CHCHO中滴入KMnO4酸性溶液,紫红色褪去 | 证明CH2=CHCHO中含有碳碳双键 |
| D | 硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 证明非金属性:Cl>Si |
| A. | A | B. | B | C. | C | D. | D |
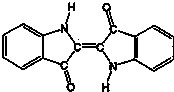
| A. | 该物质是高分子化合物 | B. | 它的分子式是C15H10N2O2 | ||
| C. | 靛蓝由碳、氢、氧、氮四种元素组成 | D. | 它是不饱和的有机物 |