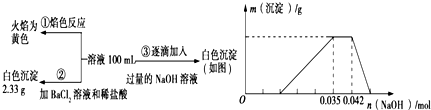
题目内容
5.下列叙述正确的是( )| A. | 铜、铁和FeCl3溶液形成的原电池,铜极放出氢气 | |
| B. | 电解硫酸钠溶液就是电解水,电解后溶液pH升高 | |
| C. | 铁锅生锈的正极反应为:O2+2H2O+4e-═4OH- | |
| D. | 工业上电解饱和食盐水的阳极反应为:2H++2e-═H2↑ |
分析 A.铜、铁和FeCl3溶液形成的原电池,发生2FeCl3+Fe═3FeCl2;
B.电解硫酸钠溶液,溶液pH不变;
C.铁锅生锈,发生吸氧腐蚀,正极生成OH-;
D.电解饱和食盐水的阳极发生氧化反应.
解答 解:A.铜、铁和FeCl3溶液形成的原电池,发生2FeCl3+Fe═3FeCl2,铜电极发生还原反应,电解方程式为2Fe3++2e-=2Fe2+,故A错误;
B.电解硫酸钠溶液,实质电解水,阳极生成氧气,阴极生成氢气,溶液呈中性,溶液pH不变,故B错误;
C.铁锅生锈,发生吸氧腐蚀,正极生成OH-,电极方程式为O2+2H2O+4e-═4OH-,故C正确;
D.电解饱和食盐水的阳极发生氧化反应,电极方程式为2Cl--2e-═Cl2↑,故D错误.
故选C.
点评 本题考查电解原理,为高频考点,侧重于学生的分析能力的考查,明确溶液中离子的放电顺序判断发生电解的物质是解答本题的关键,题目难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
15.用过量的H2SO4、NaOH、NH3•H2O、NaCl等溶液,按图所示步骤分开五种离子,则溶液①②③④是( )

| A. | ①NaCl ②NaOH ③NH3•H2O ④H2SO4 | B. | ①H2SO4 ②NaOH ③NH3•H2O ④NaCl | ||
| C. | ①NaCl ②NH3•H2O ③NaOH ④H2SO4 | D. | ①H2SO4 ②NH3•H2O ③NaOH ④NaCl |
20.下列说法错误的是( )
| A. | 工业上采用电解熔融氯化铝制取金属铝 | |
| B. | 牺牲阳极的阴极保护法实际上是利用原电池原理 | |
| C. | 将钢闸门与外电源负极相连,可防止其腐蚀 | |
| D. | 铅蓄电池充电时,铅电极与直流电源的负极相接 |
10.甲苯,己烯,氯仿,苯酚溶液,乙酸,乙醛可用( )一次性鉴别.
| A. | 溴水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 氯化铁溶液 | D. | 新制氢氧化铜悬溶液 |
17.下列说法正确的是( )
| A. | 在常温、常压下,11.2LN2含有的分子数为0.5NA | |
| B. | 将80克NaOH溶于1L水中,所得溶液的物质的量浓度为2mol/L | |
| C. | 标准状况下,18gH2O的体积是22.4L | |
| D. | 标准状况下,20mlNH3与60ml O2所含分子个数比为1:3 |
14.农药波尔多液可用于水果灭虫,是由石灰水和硫酸铜溶液混合而成的悬浊液.它不能用铁制容器盛放,是因为铁与该农药中的硫酸铜起反应.在该反应中,对铁的叙述错误的是( )
| A. | 铁发生还原反应 | B. | 铁发生氧化反应 | C. | 铁是还原剂 | D. | 铁失去电子 |
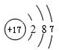 .
.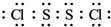 ;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,已知X是能使品红褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓.
;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,已知X是能使品红褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓.