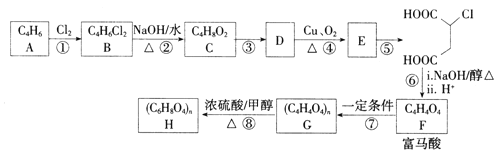
题目内容
【题目】亚硝酰氣(ClNO)常用作催化剂和合成洗涤剂,其沸点为-5.5℃,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。请回答:

Ⅰ.Cl2的制备
(1)Cl2的发生装置可以选择上图中的____________(填大写字母),反应的离子方程式为__________.
(2)欲收集一瓶干燥的氯气,选择上图中的装置,其连接顺序为:a![]() _____(按气流方向,用小写字母表示)。
_____(按气流方向,用小写字母表示)。
Ⅱ.亚硝酰氯(ClNO)的制备。实验室可用下图装置制备亚硝酰氯(ClNO);
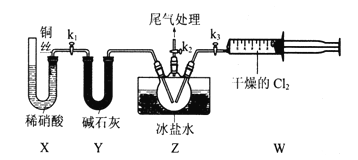
(3)实验室也可用B装置制备NO,与之相比X装置的优点为_______.
(4)在检查完装置气密性,并装入药品后,打开k2,然后再打开________(填“k1”"或“k3”),通入一段时间气体,其目的为_________。接下来,两种气体在Z中反应,当有一定量液体生成时,停止实验。
Ⅲ.亚硝酰氯(ClNO)纯度的测定
取Z中所得液体mg溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4。溶液为指示剂,用c mol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。(已知:Ag2CrO4为砖红色固体)
(5)亚硝酰氯(ClNO)与水反应的化学方程式为___________.
(6)亚硝酰氯(ClNO)的质量分数为_________(用代数式表示即可)。
【答案】 A或B MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O或B:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O f→g→c→b→d→e→j→h 排除装置内空气的干扰;可以随开随用,随关随停 K3 排尽三颈烧瓶中的空气,防止NO和ClNO变质 2ClNO+H2O=2HCl+NO↑+NO2↑
Mn2++Cl2↑+2H2O或B:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O f→g→c→b→d→e→j→h 排除装置内空气的干扰;可以随开随用,随关随停 K3 排尽三颈烧瓶中的空气,防止NO和ClNO变质 2ClNO+H2O=2HCl+NO↑+NO2↑ ![]() (或写成
(或写成![]() )
)
【解析】(1)实验室制取氯气可以利用二氧化锰与浓盐酸加热反应生成氯化锰、氯气和水,则发生装置可以选择上图中的A;反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;也可以利用高锰酸钾与浓盐酸反应生成氯化钾、氯化锰、氯气和水,则装置可以选择上图中的B;反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;(2)制得的氯气中含有氯化氢及水蒸气,所以需要利用饱和食盐水除去氯化氢后再用浓硫酸进行干燥,然后再根据氯气的密度比空气大的性质,用向上排空气法收集,氯气是大气污染物,要进行尾气处理,可利用碱石灰作吸收剂进行尾气处理,故装置的连接顺序为a
Mn2++Cl2↑+2H2O;也可以利用高锰酸钾与浓盐酸反应生成氯化钾、氯化锰、氯气和水,则装置可以选择上图中的B;反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;(2)制得的氯气中含有氯化氢及水蒸气,所以需要利用饱和食盐水除去氯化氢后再用浓硫酸进行干燥,然后再根据氯气的密度比空气大的性质,用向上排空气法收集,氯气是大气污染物,要进行尾气处理,可利用碱石灰作吸收剂进行尾气处理,故装置的连接顺序为a![]() f→g→c→b→d→e→j→h;(3)实验室也可用B装置制备NO,与之相比X装置的优点为排除装置内空气的干扰;可以随开随用,随关随停;(4)在检查完装置气密性,并装入药品后,打开k2,然后再打开k3,通入一段时间气体,其目的为排尽三颈烧瓶中的空气,防止NO和ClNO变质;(5)亚硝酰氯(ClNO)与水反应生成盐酸、一氧化氮和二氧化氮,反应的化学方程式为2ClNO+H2O=2HCl+NO↑+NO2↑;(6)取Z中所得液体mg溶于水, 25.00mL溶液中n(ClNO)=n(Cl-)=n(Ag+)=c mol/L
f→g→c→b→d→e→j→h;(3)实验室也可用B装置制备NO,与之相比X装置的优点为排除装置内空气的干扰;可以随开随用,随关随停;(4)在检查完装置气密性,并装入药品后,打开k2,然后再打开k3,通入一段时间气体,其目的为排尽三颈烧瓶中的空气,防止NO和ClNO变质;(5)亚硝酰氯(ClNO)与水反应生成盐酸、一氧化氮和二氧化氮,反应的化学方程式为2ClNO+H2O=2HCl+NO↑+NO2↑;(6)取Z中所得液体mg溶于水, 25.00mL溶液中n(ClNO)=n(Cl-)=n(Ag+)=c mol/L![]() 22.50mL
22.50mL![]() 10-3L/mL=0.0225cmol,亚硝酰氯(ClNO)的质量分数为
10-3L/mL=0.0225cmol,亚硝酰氯(ClNO)的质量分数为![]() 。
。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | 69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) 2C(s)+O2(g)=2CO(g)
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的化学方程式:________________
② 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是_____________________。
③ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
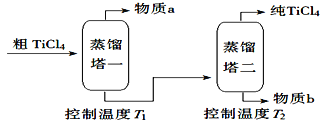
物质a是_________,T2应控制在_________