题目内容
8.试写出相应的离子方程式:(1)足量的NaHSO4溶液与Ba(HCO3)2溶液混合;
(2)足量的Ba(HCO3)2溶液与NaHSO4溶液混合.
分析 (1)硫酸氢钠足量,离子方程式按照碳酸氢钡的化学式书写,反应生成硫酸钡、硫酸钠、二氧化碳气体和水;
(2)碳酸氢钡足量,离子方程式按照硫酸氢钠的化学式书写,反应生成碳酸氢钠、硫酸钡、二氧化碳气体和水,据此写出反应的离子方程式.
解答 解:(1)足量的NaHSO4溶液与Ba(HCO3)2溶液混合,离子方程式按照碳酸氢钡的化学式书写,反应生成硫酸钡、硫酸钠、二氧化碳气体和水,反应的离子方程式为:,
答:足量的NaHSO4溶液与Ba(HCO3)2溶液混合的离子方程式为Ba2++SO42-+2H++2HCO3-═BaSO4+2H2O+2CO2↑;
(2)足量的Ba(HCO3)2溶液与NaHSO4溶液混合,离子方程式按照硫酸氢钠的化学式书写,反应生成碳酸氢钠、硫酸钡、二氧化碳气体和水,反应的离子方程式为:Ba2++SO42-+H++HCO3-═BaSO4+H2O+CO2↑,
答:足量的Ba(HCO3)2溶液与NaHSO4溶液混合为Ba2++SO42-+H++HCO3-═BaSO4+H2O+CO2↑.
点评 本题考查了离子方程式的书写,题目难度中等,明确反应物过量情况对生成物的影响为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
1.下列各组离子既能与镁粉反应,又能大量共存,且其溶液为无色溶液的是( )
| A. | Ca2+、Cl-、$MnO_4^-$、Na+ | B. | K+、Cl-、$SO_4^{2-}$、H+ | ||
| C. | OH-、Na+、Al3+、I- | D. | H+、Cl-、Ba2+、Ag+ |
19.短周期元素X、Y、W、R的原子序数依次增大,元素X是形成化合物种类最多的元素,Y、R同主族,R原子的最外层电子数是内层电子总数的一半,W单质是人类将太阳能转变为电能的常用材料.下列说法正确的是( )
| A. | W元素是硅元素 | |
| B. | 气态氢化物的稳定性:Y<R | |
| C. | X、W、Y的最高价氧化物的水化物酸性强弱顺序是X<Y<W | |
| D. | X、Y、W、R的原子半径由大到小的顺序为R>W>X>Y |
16.电子构型为[Ar]3d104s2的元素属于( )
| A. | s区 | B. | p区 | C. | d 区 | D. | ds区 |
13.在标准状况时密度为2.5g/L的是( )
| A. | C4H8 | B. | C2H4 | C. | C2H2 | D. | CH4 |
5.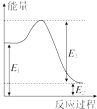 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热为△H=-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ
C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如下表:
则△H1=-116kJ•mol-1,在相应的反应条件下,将1mol CO(g)与足量H2混合充分反应后,放出或吸收的热量<△H1.(用>,<或=填空)
 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热为△H=-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ
C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
2.如图为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )

| A. | 原子半径大小为:B>A>C | B. | 核电荷数:D>C>B>A | ||
| C. | A与D形成的化合物均是离子键 | D. | 生成的氢化物的稳定性为:D>A>B |
3.已知断裂1mol C-H键,要吸收热量414.4kJ;断裂1mol C-C键,要吸收热量347.4kJ;生成1mol C═C键,会放出热量615.3kJ;生成1mol H-H键,会放出热量435.3kJ,某有机物分解的反应可表示为:

若在反应中消耗了1mol乙烷,则有关该反应的说法正确的是( )

若在反应中消耗了1mol乙烷,则有关该反应的说法正确的是( )
| A. | 该反应放出251.2 kJ的热量 | B. | 该反应吸收251.2 kJ的热量 | ||
| C. | 该反应放出125.6 kJ的热量 | D. | 该反应吸收125.6 kJ的热量 |