题目内容
3.54g水的物质的量是3mol,含有分子数约是3×6.02×1023,含有O原子的个数约是3×6.02×1023.分析 根据n=$\frac{m}{M}$计算水的物质的量,根据N=nNA计算水分子数目,氧原子数目等于水分子数目.
解答 解:54g水的物质的量是$\frac{54g}{18g/mol}$=3mol,含有分子数是3mol×6.02×1023mol-1=3×6.02×1023,氧原子数目等于水分子数目,即含有O的个数约是3×6.02×1023,
故答案为:3mol;3×6.02×1023;3×6.02×1023.
点评 本题考查物质的量有关计算,注意掌握以物质的量为中心的有关计算,侧重对基础知识的巩固.

练习册系列答案
相关题目
16.将过量的金属锌投入到含0.200mol H2SO4的热浓硫酸中,下列判断正确的是( )
| A. | 因发生“钝化”而不反应 | B. | 产生的SO2为0.100 mol | ||
| C. | 产生的SO2少于0.100 mol | D. | 除SO2外还会有H2产生 |
14.“绿色化学”追求减少化工生产对环境造成的污染,下列物质可称为“绿色氧化剂”的是( )
| A. | 浓硫酸 | B. | “84”消毒液 | C. | 漂白粉 | D. | 双氧水 |
11.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
| A. | 元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大 | |
| B. | 39g Z2Y2中含有的离子数约为1.204×1024 | |
| C. | 元素Z、R的氧化物的水化物之间相互反应生成的盐一定是正盐 | |
| D. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
18.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4 NH3•H2O═[Al(OH)4]-+4NH4+ | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
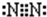 ;乙分子的结构式
;乙分子的结构式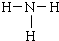 .
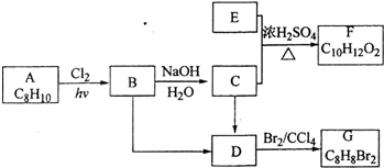
.

 +H2O
+H2O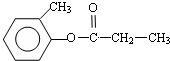 、
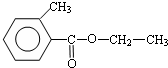
、
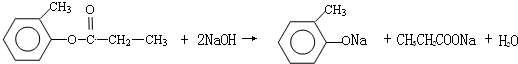 .
.