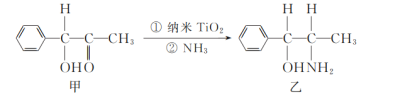
题目内容
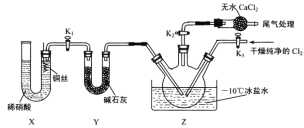
【题目】如图所示是一个制取氯气并以氯气为原料进行特定反应的装置,多余的氯气可以贮存在b瓶中,其中各试剂瓶中所装试剂为:C(氯化亚铁溶液)、D(碘化钾淀粉溶液)、E(紫色石蕊试液)、G(含酚酞的氢氧化钠溶液)

(1)A是氯气的发生装置,反应的离子方程式为________________________。
(2)a仪器的名称为_________________,B中宜加入的液体是_________________。
(3)实验开始后C中反应的离子方程式是________________________________,D中的现象是___________________,E中的现象是____________________________。
(4)F装置中硬质玻璃管内盛有炭粉,若F中发生氧化还原反应,其产物为二氧化碳和氯化氢,则F中反应的化学方程式为___________________________________________。
(5)G中发生氧化还原反应的离子方程式为________________________________。
(6)F处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,则装置B中的现象是____________________________;若发现装置B中该现象不明显,可能的原因是A或B装置漏气,查找原因时若用蘸有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程式_____________________________。
【答案】MnO2+4H++2Cl-(浓)![]() Mn2++Cl2↑+2H2O 圆底烧瓶 饱和食盐水 2Fe2++Cl2=2Fe3++2Cl- 溶液变蓝 由紫色变为红色,再变为无色 2Cl2+C+2H2O
Mn2++Cl2↑+2H2O 圆底烧瓶 饱和食盐水 2Fe2++Cl2=2Fe3++2Cl- 溶液变蓝 由紫色变为红色,再变为无色 2Cl2+C+2H2O ![]() 4HCl+CO2 Cl2+2OH-=Cl-+ClO-+H2O 装置B中瓶内液面下降,长颈漏斗中液面上升 3Cl2+8NH3=N2+6NH4Cl
4HCl+CO2 Cl2+2OH-=Cl-+ClO-+H2O 装置B中瓶内液面下降,长颈漏斗中液面上升 3Cl2+8NH3=N2+6NH4Cl
【解析】
A中浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,b瓶是用来贮存Cl2的,则应选用一种Cl2在其中溶解度非常小的液体,一般选用饱和食盐水。实验开始后,Cl2可与C中氯化亚铁反应得到三价铁离子,Cl2从D中置换出单质碘从而使D中溶液变蓝色,E中紫色石蕊试液先变红后褪色,G用来吸收多余的氯气。
(1)浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,反应的离子方程式为MnO2+4H++2Cl-(浓)![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)仪器a为圆底烧瓶;B中试剂应选用一种Cl2在其中溶解度非常小的液体,一般选用饱和食盐水。
(3)Cl2可与C中的氯化亚铁发生氧化还原反应:2Fe2++Cl2=2Fe3++2Cl-;Cl2从D中置换出单质碘从而使D中溶液变蓝色;氯气溶于水显酸性,并生成具有漂白性的次氯酸,故E中溶液由紫色变为红色,再变为无色。
(4)F装置中硬质玻璃管内盛有炭粉,若F中发生氧化还原反应,其产物为二氧化碳和氯化氢,反应方程式为Cl2+C+2H2O ![]() 4HCl+CO2。
4HCl+CO2。
(5)G中氢氧化钠与剩余的氯气发生反应,得到次氯酸钠、氯化钠和水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
(6)F处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,导致A中压强大于B,使装置B中瓶内液面下降,长颈漏斗中液面上升;查找原因时浓氨水挥发出的氨气与泄露的氯气反应生成氯化铵,化学方程式为3Cl2+8NH3=N2+6NH4Cl。