题目内容
20.碳,硅,锗,锡,铅的单质及化合物是重要的工业材料.(1)金刚石和石墨都是碳的两种同素异形体,相同条件下石墨更稳定,则石墨转化为金刚石的反应是吸热(填“放热”或“吸热”)反应.
(2)SiO2在通信领域的一种重要用途是光导纤维的材料.SiO2晶体中的基本结构单元是SiO2
(3)SnCl2有较强的还原性,写出SnCl2与FeCl3溶液反应的离子方程式Sn2++2Fe3+=Sn4++2Fe2+
(4)铅丹(Pb3O4)可作为防锈用涂料,呈红褐色,可采用PbS在空气中连续氧化的方法制备:PbS→PbO→Pb3O4,写出第一步氧化的化学方程式2PbS+3O2=2PbO+2SO2,铅丹曾用于铁制品防锈,请说明它的主要危害导致人体中毒,1mol铅丹与足量浓盐酸反应时,转移的电子数目为2NA,写出该反应的化学方程式Pb3O4+8HCl(浓)═3PbCl2+Cl2↑+4H2O.
分析 (1)相同条件下石墨更稳定,则石墨能量低;
(2)SiO2为原子晶体,对光具有良好的全反射作用;
(3)Sn2+与Fe3+发生氧化还原反应;
(4)第一步氧化发生PbS与氧气的反应生成PbO和SO2;铅丹曾用于铁制品防锈,溶解后的铅离子有毒;1mol铅丹与足量浓盐酸反应时,转移的电子数目为2NA,则只有2molPb得到电子转化为+2价,以此来解答.
解答 解:(1)相同条件下石墨更稳定,则石墨能量低,可知石墨转化为金刚石的反应是吸热反应,故答案为:吸热;
(2)SiO2对光具有良好的全反射作用,可用作光导纤维的材料,为原子晶体,SiO2晶体中的基本结构单元是SiO2,故答案为:光导纤维的材料;SiO2;
(3)Sn2+与Fe3+发生氧化还原反应,离子反应为Sn2++2Fe3+=Sn4++2Fe2+,故答案为:Sn2++2Fe3+=Sn4++2Fe2+;
(4)第一步氧化发生PbS与氧气的反应生成PbO和SO2,反应为2PbS+3O2=2PbO+2SO2;铅丹曾用于铁制品防锈,溶解后的铅离子有毒,主要危害为导致人体中毒;1mol铅丹与足量浓盐酸反应时,转移的电子数目为2NA,则只有2molPb得到电子转化为+2价,同时Cl失去电子转化为氯气,发生的反应为Pb3O4+8HCl(浓)═3PbCl2+Cl2↑+4H2O,
故答案为:2PbS+3O2=2PbO+2SO2;导致人体中毒;Pb3O4+8HCl(浓)═3PbCl2+Cl2↑+4H2O.
点评 本题考查金属及化合物的性质及综合应用,为高频考点,涉及反应中能量变化、氧化还原反应及离子反应等,综合性较强,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
11.据某本书所述,关节炎病的病因是在关节滑液中形成尿酸钠晶体,尤其是在寒冷季节诱发关节疼痛,其化学机理为:1HUr(尿酸)+H2O?Ur-(尿酸根离子)+H3O+;2Ur-(aq)+Na-(aq)?NaUr(s)下列对反应2的叙述正确的是( )
| A. | 反应的△H>0 | B. | 降低温度,平衡向逆反应方向移动 | ||
| C. | 反应的△H<0 | D. | 升高温度,平衡向正反应方向移动 |
8.有A、B、C、D四块金属片,进行如下实验:
①A、B用导线相连后,同时浸入稀硫酸溶液中,A为负极
②将A、D分别投入等浓度盐酸中,D比A反应剧烈
③将铜浸入B的盐溶液里,无明显变化
④把铜浸入C的盐溶液里,有银白色物质析出.
据此,四种金属的活动性有强到弱的顺序是( )
①A、B用导线相连后,同时浸入稀硫酸溶液中,A为负极
②将A、D分别投入等浓度盐酸中,D比A反应剧烈
③将铜浸入B的盐溶液里,无明显变化
④把铜浸入C的盐溶液里,有银白色物质析出.
据此,四种金属的活动性有强到弱的顺序是( )
| A. | D>A>B>C | B. | A>C>D>B | C. | B>D>C>A | D. | A>B>C>D |
15.酚酞的结构简式如图,下列关于酚酞的说法一定正确的是( )
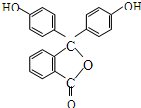

| A. | 酚酞的分子式是C20H12O4 | B. | 分子中的所有碳原子不在同一平面 | ||
| C. | 1mol酚酞最多可能消耗2mol NaOH | D. | 1mol酚酞可与10mol H2加成 |
13.工业上用碳还原SiO2制取单质硅会发生如下副反应:SiO2+3C═SiC+2CO↑.该反应中氧化剂与还原剂的质量比为( )
| A. | 36:60 | B. | 60:36 | C. | 1:2 | D. | 1:3 |
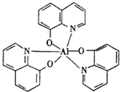 2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8-羟基喹啉铝等.
2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8-羟基喹啉铝等.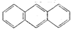 属于非极性(填“极性”“非极性”)分子
属于非极性(填“极性”“非极性”)分子
 .
. .
.