题目内容
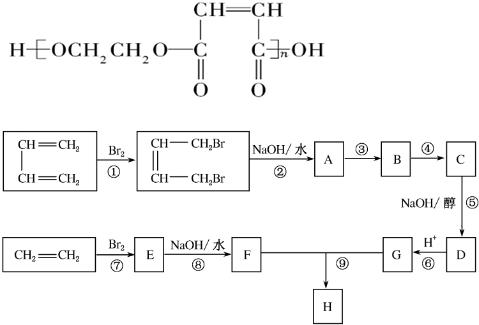
19.已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K,L,M三个电子层.回答下列问题:(1)A、B、C、D、E、F、G几种元素中第一电离能最小的是K (填元素符号),D元素的原子核外有17种不同运动状态的电子;有5种不同能级的电子.基态的F3+核外电子排布式是1s22s22p63s23p63d5.
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是NH3与H2O分子间存在氢键,CH4、H2S分子与H2O分子间不存在氢键.
(3)化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是
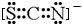 .
.(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是K2Fe(SCN)5.
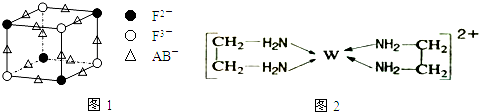
(5)化合物EF[F(AB)6]是一种蓝色晶体,图1表示其晶胞的$\frac{1}{8}$(E+未画出).该蓝色晶体的一个晶胞中E+的个数为4.
(6)G的二价阳离子(如图2所示)能与乙二胺(H2N-CH2一CH2一NH2)形成配离子:该配离子中含有的化学键类型有abd.(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
阴离子CAB-中的A原子与乙二胺(H2N-CH2一CH2一NH2)中C原子的杂化方式为sp、sp3.
分析 A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,则A是C元素,C是S元素,透过蓝色钴玻璃观察E的焰色反应为紫色,E是K元素,D的原子序数介于S与K元素之间,故D为Cl元素,B的电负性大于C,且B的原子序数小于硫,由B与S、Cl属于不同主族,所以B是N元素,F位于第四周期,基态原子中有4个未成对电子,外围电子排布为3d64s2,则F是Fe元素,G的+1价阳离子正好充满K,L,M三个电子层,则G原子的核外电子数为2+8+18+1=29,故G为Cu.
(1)金属性越强,第一电离能越小;原子核外没有运动状态相同的电子,结合核外电子排布式确定不同能级的电子种数;根据核外电子排布规律书写基态的Fe3+核外电子排布式,注意原子失去电子的顺序是从最外层到里层;
(2)氨气分子与水分子之间存在氢键,影响物质的溶解性;
(3)化合物ECAB为KSCN,其中阴离子是SCN-,AC2是CS2,根据二硫化碳的电子式写出硫氰根离子的电子式;
(4)氯化铁和硫氰化钾溶液混合生成络合物,根据化合物中化合价的代数和为0写出该化学式;
(5)化合物EF[F(AB)6]是KFe[Fe(CN)6],利用均摊法计算一个晶胞的$\frac{1}{8}$中含有的离子,结合化学式确定钾离子个数;
(6)Cu的二价阳离子能与乙二胺(H2N-CH2一CH2一NH2)形成配离子,配离子中C-C原子之间存在非极性键、C-N和C-H及N-H原子之间存在极性键,铜离子和氮原子之间存在配位键;
SCN-中的C原价层电子对个数是2且不含孤电子对,所以C原子杂化方式为sp,乙二胺(H2N-CH2一CH2一NH2)中C原子价层电子对个数是4且不含孤电子对,所以C的杂化方式为sp3.
解答 解:A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,则A是C元素,C是S元素,透过蓝色钴玻璃观察E的焰色反应为紫色,E是K元素,D的原子序数介于S与K元素之间,故D为Cl元素,B的电负性大于C,且B的原子序数小于硫,由B与S、Cl属于不同主族,所以B是N元素,F位于第四周期,基态原子中有4个未成对电子,外围电子排布为3d64s2,则F是Fe元素,G的+1价阳离子正好充满K,L,M三个电子层,则G原子的核外电子数为2+8+18+1=29,故G为Cu.
(1)元素的金属性越强,其第一电离能越小,这几种元素中金属性最强的是K,则第一电离能最小的是K;
D是Cl元素,原子核外电子排布为1s22s22p63s23p5,原子核外没有运动状态相同的电子,所以Cl元素原子核外电子有17种运动状态,有5种不同的能级;F是Fe元素,失去三个电子生成铁离子,铁离子核外有23个电子,根据构造原理知铁离子核外电子排布式为:1s22s22p63s23p63d5,
故答案为:K;17;5;1s22s22p63s23p63d5;
(2)B的氢化物是氨气、C的氢化物是硫化氢、A的氢化物是甲烷,硫化氢、甲烷和水分子不能形成氢键、氨气和水分子能形成氢键,氢键的存在促进其溶解度增大,所以氨气的溶解度大于甲烷和硫化氢,
故答案为:NH3与H2O分子间存在氢键,CH4、H2S分子与H2O分子间不存在氢键;
(3)化合物ECAB为KSCN,其中阴离子是SCN-,AC2是CS2,其电子式为 ,SCN-与CS2互为等电子体,则硫氰根离子的电子式为
,SCN-与CS2互为等电子体,则硫氰根离子的电子式为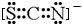 ,
,
故答案为: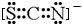 ;
;
(4)FeCl3与KSCN溶液混合得到含多种配合物的血红色溶液,生成的配合物为铁氰化钾,其中配位数为5的配合物的化学式是K2Fe(SCN)5,故答案为:K2Fe(SCN)5;
(5)晶胞的$\frac{1}{8}$(E+未画出)中,亚铁离子个数=4×$\frac{1}{8}$=$\frac{1}{2}$,铁离子个数=4×$\frac{1}{8}$=$\frac{1}{2}$,CN-离子个数=12×$\frac{1}{4}$,所以晶胞中亚铁离子个数是$\frac{1}{2}$×8=4,铁离子个数是$\frac{1}{2}$×4=4,CN-离子个数=3×8=24,化合物EF[F(AB)6]是KFe[Fe(CN)6],根据各离子的个数比知,晶胞中钾离子个数是4,
故答案为:4;
(6)Cu的二价阳离子能与乙二胺(H2N-CH2一CH2一NH2)形成配离子(如图2),C-C原子之间存在非极性键、C-N和C-H及N-H原子之间存在极性键,铜离子和氮原子之间存在配位键,所以该配离子中含有的化学键类型有配位键、极性键、非极性键,故选abd;
SCN-中的C原价层电子对个数是2且不含孤电子对,所以C原子杂化方式为sp,乙二胺(H2N-CH2一CH2一NH2)中C原子价层电子对个数是4且不含孤电子对,所以C的杂化方式为sp3,
故答案为:abd;sp、sp3.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、氢键、等电子体、配合物、化学键、晶胞计算、杂化方式判断等,侧重考查学生分析应用能力,注意(5)中图不是一个晶胞,为易错点.

| A. | 标准状况下,2.24L煤油(设为C8H18)中含有4.816×1023个碳原子 | |
| B. | 常温常压下,O2和O3的混合物16g中含有6.02×1023个氧原子 | |
| C. | 25℃时,1L 0.1mol•L-1的氢氧化钠溶液中含有6.02×1023个OH- | |
| D. | 0.5mol CH4中含有3.01×1023个电子 |
| 电离能/kJ/mol | I1 | I2 | I3 | I4 |
| X | 738 | 1451 | 7733 | 10540 |
| Y | 578 | 1817 | 2745 | 11575 |
(2)基态Z原子的核外电子排布式为[Ar]3d54s1.该基态原子共有24种不同运动状态的电子.
(3)试写出U元素单质的2种等电子体,①CO,②CN-.
(4)将W的单质通入NaOH溶液中可得到VW2.VW2是一种无色、几乎无味的剧毒气体,主要用于氧化反应,火箭工程、助燃剂等.
①VW2中V原子的杂化轨道类型是sp3,VW2分子的空间构型为V形.
②与H2O分子相比,VW2分子的极性更小(填“大”或“小”),原因是F的电负性大于O,导致正负电荷中心偏离程度减小.
(5)金属Z内部原子的堆积方式与Na相同,都是体心立方堆积方式.则晶胞中Z的配位数为8,若该晶胞的边长为289pm,NA取值为6.02×1023,Z原子的摩尔质量为52g/mol,则Z的密度为7.1g/cm3.Z原子与次近的Z原子的核间距离为289pm.
| A. | CO2+H2O═H2CO3 | B. | C+O2═CO2 | ||
| C. | CO2+2KOH═K2CO3+H2O | D. | CaO+CO2═CaCO3 |
| A. | 在101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| C. | 在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.31 kJ•mol-1.若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
| A. | NaCN中氮元素的化合价为+3 | |
| B. | 用双氧水处理现场前,应紧急疏散群众 | |
| C. | 每生成1molNH3转移2mol电子 | |
| D. | NaCN中既含有离子键又含有共价键的 |