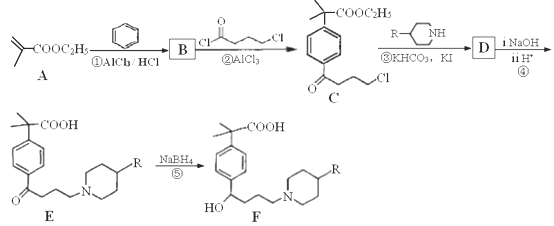
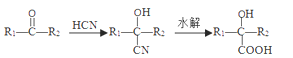
��Ŀ����
����Ŀ������п����������п���ס�ӡȾýȾ���ȡ���п����Ҫ�ɷ�ΪZnO��������FeO��CuO��SiO2�����ʣ��Ʊ�ZnSO4��7H2O���������¡�
��֪��Ksp[Fe(OH)3]��4.0��1038��Ksp[Cu(OH)2]��2.2��1020
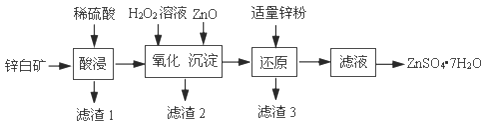
��1��������1������Ҫ�ɷ���_______���ѧʽ����������������У�Ϊ�����пԪ�ؽ������ʣ��ɲ�ȡ�Ĵ�ʩ�У����ʵ�������Ũ�ȣ���_______����һ������
��2����������������������������ԭ��Ӧ�����ӷ���ʽ��_______��
��3���������������У�����ZnO����Fe(OH)3������ԭ����_______��
��4����������ZnO���壬��ֻ����Fe(OH)3������δ����Cu(OH)2�������Ҳ�ó��������Һ��c(Fe3��)��4.0��1014mol/L����ʱ��Һ��c(Cu2��)��ȡֵ��Χ��_______mol/L��
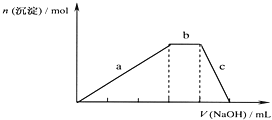
��5����������п�۵�������_______��
��6������Һ�õ�ZnSO47H2O�IJ�������Ϊ_______��_______�����ˡ�ϴ�ӡ����ʵ�����й��˲�����Ҫʹ�õIJ����������ձ���_______��_______��
���𰸡� SiO2 ����п����ֽ��转�ϻ��ʵ����ȵ� 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3+����Һ�д���ˮ��ƽ��:Fe3++3H2O![]() Fe(OH)3+3H+,����ZnO����H+��Ӧ��H+Ũ�ȼ�С��ˮ��ƽ��������У�����Fe(OH)3���� <2.2��10-4 ��ȥ��Һ�е�Cu2+ ����Ũ�� ��ȴ�ᾧ ©�� ������
Fe(OH)3+3H+,����ZnO����H+��Ӧ��H+Ũ�ȼ�С��ˮ��ƽ��������У�����Fe(OH)3���� <2.2��10-4 ��ȥ��Һ�е�Cu2+ ����Ũ�� ��ȴ�ᾧ ©�� ������
��������������Ҫ������п���Ʊ�ZnSO4��7H2O�����̵����ۡ�
��1��������1������Ҫ�ɷ��Dz�����ϡ�����SiO2��������������У�Ϊ�����пԪ�ؽ������ʣ��ɲ�ȡ�Ĵ�ʩ�У����ʵ�������Ũ�ȣ��ڷ���п����ֽ��转�ϻ��ʵ����ȵȡ�
��2���������������У�����������ԭ��Ӧ�����ӷ���ʽ��2Fe2++H2O2+2H+=2Fe3++2H2O��
��3���������������У�����ZnO����Fe(OH)3������ԭ����Fe3+����Һ�д���ˮ��ƽ��:Fe3++3H2O![]() Fe(OH)3+3H+������ZnO����H+��Ӧ��H+Ũ�ȼ�С��ˮ��ƽ��������У�����Fe(OH)3������
Fe(OH)3+3H+������ZnO����H+��Ӧ��H+Ũ�ȼ�С��ˮ��ƽ��������У�����Fe(OH)3������
��4��c(OH��)��( =10-8mol/L����ʱ��Һ��c(Cu2��)=
=10-8mol/L����ʱ��Һ��c(Cu2��)= 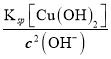 <2.2��10-4 mol/L��
<2.2��10-4 mol/L��
��5����������п�۵������dz�ȥ��Һ�е�Cu2+��
��6������Һ�õ�ZnSO47H2O�IJ�������Ϊ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����ʵ�����й��˲�����Ҫʹ�õIJ����������ձ���©������������

 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д� Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�