题目内容
【题目】铜碘杂化团簇具有优异的光学性能,可用于制备发光二极管、发光墨水、生物成像仪器等。一种铜碘杂化团簇的合成路线如图:
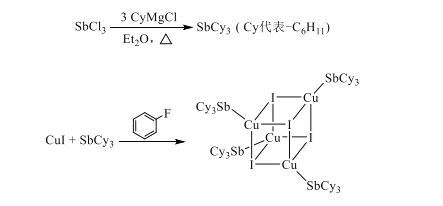
(1)已知SbCl3(三氯化锑)是挥发性显著的物质,由此判断SbCl3中主要含有的化学键类型是___。
(2)Sb为第四周期VA族元素,预测SbCl3的立体结构为___。
(3)Et2O(CH3CH2OCH2CH3,乙醚)中氧原子以及![]() 中碳原子的杂化类型分别是___、___。
中碳原子的杂化类型分别是___、___。
(4)CuI中Cu+的核外电子排布式为___。
(5)SbCy3只能与一个Cu+配位的原因是___。
(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为anm、bnm、cnm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇,该团簇的化学式为___。设阿伏加德罗常数的值为NA,已知SbCy的相对分子量是371,则该铜碘杂化团簇的密度是___g·cm-3(列计算式)。
【答案】共价键 三角锥形 sp3 sp2 1s22s22p63s63p63d10或[Ar]3d10 SbCy3中Sb只含一对孤对电子 Cu4I4(SbCy3)4或Cu4I4Sb4Cy12或Cu4I4Sb4C72H132 ![]()
【解析】
(1)SbCl3属于挥发性显著的物质属于共价化合物,含有共价键;
(2)根据VSEPR模型判断杂化方式,再判断分子的立体构型;
(3)根据VSEPR模型判断杂化方式;
(4)根据构造原理写出29号元素Cu的核外电子排布式,再写出Cu+的核外电子排布式;
(5)根据SbCy3的结构确定只能与一个Cu+配位的原因;
(6)根据铜碘杂化团簇的铜原子,碘原子,SbCy3的数目,写出团簇的化学式;利用![]() 进行计算。
进行计算。
(1)已知SbCl3(三氯化锑)是挥发性显著的物质,说明沸点低,一般为共价化合物,主要含有的化学键类型是共价键;
(2)Sb为第四周期VA族元素,最外层5个电子,SbCl3分子中Sb与三个氯原子形成三对单键,剩余一对孤对电子,杂化方式为sp3,SbCl3分子的立体结构为三角锥形;
(3)Et2O(CH3CH2OCH2CH3,乙醚)中氧原子成了两对单键,剩余两对孤对电子,价层电子对为4对,杂化方式为sp3杂化, ![]() 中六个碳原子共平面,碳原子的杂化类型sp2杂化,剩余一个p轨道垂直于苯环的平面形成一个大π键;
中六个碳原子共平面,碳原子的杂化类型sp2杂化,剩余一个p轨道垂直于苯环的平面形成一个大π键;
(4)29号元素Cu的核外电子排布式为:1s22s22p63s63p63d104s1或[Ar]3d104s1,CuI中Cu+失去最外层的一个电子,核外电子排布式为1s22s22p63s63p63d10或[Ar]3d10;
(5)SbCy3中Sb只含一对孤对电子,故只能与一个Cu+配位;
(6)根据图示,铜碘杂化团簇的铜原子,碘原子,SbCy3个数都为4个,该团簇的化学式为Cu4I4(SbCy3)4或Cu4I4Sb4Cy12由于SbCy3中Cy为C6H11,故分子式还可以是Cu4I4Sb4C72H132;
设阿伏加德罗常数的值为NA,已知SbCy的相对分子量是371,晶胞参数分别为anm、bnm、cnm,棱间夹角为α=β=γ=90°,晶胞的体积为a×b×c×10-21 cm-3,则该铜碘杂化团簇的密度是
![]() 。
。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案