题目内容
【题目】乙醇是一种重要的化工原料和燃料,常见合成乙醇的途径如下:
(1)乙烯气相直接水合法:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=akJ·mol-1
已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH2=-1323.0kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-1278.5kJ·mol-1,则a=__。
(2)工业上常采用CO2和H2为原料合成乙醇,某实验小组将CO2(g)和H2(g)按1:3的比例置于一恒容密闭容器中发生反应:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ΔH=bkJ·mol-1。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。
C2H5OH(g)+3H2O(g) ΔH=bkJ·mol-1。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。
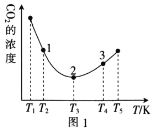
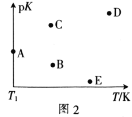
①由图1可知,b=__(填“![]() ”“
”“![]() ”或“<”)0。
”或“<”)0。
②在T1~T2及T4~T5两个温度区间内,容器中CO2(g)的浓度呈现如图1所示的变化趋势,其原因是___。
③图1中点1、2、3对应的逆反应速率v1、v2、v3中最大的是___(填“v1”“v2”或“v3”);要进一步提高H2(g)的转化率,可采取的措施有___(任答一条)。
④图2中当温度为T1时,pK的值对应A点,则B、C、D、E四点中表示错误的是__。
⑤乙烯气相直接水合法过程中会发生乙醇的异构化反应:C2H5OH(g)![]() CH3OCH3(g) ΔH=+50.7kJ·mol-1,该反应的速率方程可表示为v正=k正c(C2H5OH)和v逆=k逆c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)__(填“
CH3OCH3(g) ΔH=+50.7kJ·mol-1,该反应的速率方程可表示为v正=k正c(C2H5OH)和v逆=k逆c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)__(填“![]() ”“
”“![]() ”或“<”) Ea(逆),已知:T℃时,k正=0.006s-1,k逆=0.002s-1,该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚,此时反应__(填“正向”或“逆向”)进行。
”或“<”) Ea(逆),已知:T℃时,k正=0.006s-1,k逆=0.002s-1,该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚,此时反应__(填“正向”或“逆向”)进行。
【答案】-44.5 < T1~T2区间,化学反应未达到平衡,反应正向进行,温度越高,反应速率越快,所以CO2的浓度随温度的升高而减小;T3以后曲线上对应的点均达到平衡,该反应的正反应是放热反应,温度升高,平衡逆向移动,CO2的浓度随温度的升高而增大 v3 提高CO2的浓度或适当降温或及时移出生成物 BE > 正向
【解析】
(1) 已知:I:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH2=-1323.0kJ·mol-1
II:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-1278.5kJ·mol-1;
根据盖斯定律I-II可得C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=ΔH2-ΔH3=(-1323.0kJ·mol-1)-(-1278.5kJ·mol-1)=-44.5 kJ·mol-1;
(2)①据图可知当温度低于T3时随温度上升,CO2的浓度下降,而温度高于T3时随温度上升,CO2的浓度上降,说明相同时间内温度低于T3时反应没有达到平衡,而温度高于T3时,该时段内反应达到平衡,且温度上升平衡左移CO2的浓度上降,所以正反应为放热反应,所以b<0;
②T1~T2区间,化学反应未达到平衡,反应正向进行,温度越高,反应速率越快,所以CO2的浓度随温度的升高而减小;T3以后曲线上对应的点均达到平衡,该反应的正反应是放热反应,温度升高,平衡逆向移动,CO2的浓度随温度的升高而增大;
③温度越高反应速率越快,所以逆反应速率最大的是v3;提高CO2的浓度或及时移出生成物,平衡都可以正向移动增大氢气的转化率,该反应正反为放热反应,适当降低温度也可以提高提高氢气的转化率;
④该反应为放热反应,所以温度越高平衡常数越小,则pK越大,所以BE二点表示错误;
⑤该反应焓变大于0,焓变=正反应活化能-逆反应活化能>0,所以Ea(正)> Ea(逆);反应达到平衡时正逆反应速率相等,即v正=k正c(C2H5OH)=v逆=k逆c(CH3OCH3),所以有![]() ,T℃时,k正=0.006s-1,k逆=0.002s-1,所以该温度下平衡常数K=
,T℃时,k正=0.006s-1,k逆=0.002s-1,所以该温度下平衡常数K=![]() =3,该反应前后气体系数之和相等,所以可以用物质的量代替浓度计算浓度商和平衡常数, 所以该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚时,浓度商Q=
=3,该反应前后气体系数之和相等,所以可以用物质的量代替浓度计算浓度商和平衡常数, 所以该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚时,浓度商Q=![]() <3,所以此时反应正向移动。
<3,所以此时反应正向移动。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。下列文物修复和保护的过程中涉及化学变化的是( )
A | B | C | D |
|
|
|
|
银器用除锈剂除锈 | 变形的金属香炉复原 | 古画水洗除尘 | 木器表面擦拭烫蜡 |
A.AB.BC.CD.D