题目内容
19.W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18,下列说法正确的是( )| A. | 氢化物稳定性:Y>Z | |
| B. | XW3与WZ相遇,产生大量白烟 | |
| C. | 氧化物的水化物的酸性:Y<Z | |
| D. | X与Z不能同时存在于同一离子化合物中 |
分析 W、X、Y、Z均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,则W是H元素,X是N元素,Y、Z为第三周期元素;它们的最外层电子数之和为18,W最外层电子数是1,X最外层电子数是5,Y、Z最外层电子数之和是12,且二者都是主族元素,Y原子序数小于Z,则Y是P元素、Z是Cl元素,
A.非金属性越强,对应氢化物越稳定;
B.氨气与氯化氢反应生成氯化铵,有白雾生成;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.X、Y分别是N、P元素,可能存在磷酸铵、磷酸一氢铵、磷酸二氢铵中.
解答 解:W、X、Y、Z均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,则W是H元素,X是N元素,Y、Z为第三周期元素;它们的最外层电子数之和为18,W最外层电子数是1,X最外层电子数是5,Y、Z最外层电子数之和是12,且二者都是主族元素,Y原子序数小于Z,则Y是P元素、Z是Cl元素,
A.Y是P元素、Z是Cl元素,非金属性P<Cl,则二者对应氢化物稳定性:P<Cl,故A错误;
B.XW3为氨气,WZ为HCl,氨气与氯化氢相遇生成氯化铵,有白雾生成,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性P<Cl,最高价氧化物的水化物酸性H3PO4<HClO4,但氧化物的水化物的酸性不一定存在此规律,如磷酸酸性大于次氯酸,故C错误;
D.X、Y分别是N、P元素,可能存在磷酸铵、磷酸一氢铵、磷酸二氢铵中,磷酸铵、磷酸一氢铵、磷酸二氢铵都是铵盐,属于离子化合物,故D错误;
故选B.
点评 本题考查原子结构和元素性质,为高频考点,题目难度中等,涉及离子化合物判断、酸性强弱判断、元素周期律等知识,正确判断元素是解本题关键,结合物质的结构性质解答,易错选项是C,注意需要指出最高价.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 质量数为37的氯原子${\;}_{37}^{17}$Cl | B. | 钠原子的电子式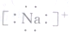 | ||
| C. | 硫原子的结构示意图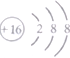 | D. | 铝离子的结构示意图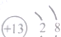 |
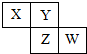 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )| A. | Z单质与氢气反应较Y剧烈 | |
| B. | 最高价氧化物对应水化物酸性W比Z强 | |
| C. | X单质氧化性强于Y单质 | |
| D. | X与W的原子核外电子数相差9 |
| A. | 检验鸡蛋壳能否溶解在酸中 | B. | 检验食盐中是否加碘 | ||
| C. | 除去热水瓶内壁上的水垢 | D. | 鉴别食盐和纯碱 |
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量⑧混合气体的总体积.
| A. | ①③④⑤ | B. | ①②③④⑤⑦ | C. | ①③④⑤⑧ | D. | ①②③④⑤⑥⑦⑧ |
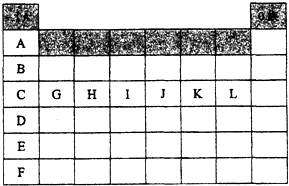 如图是元素周期表中各主族(A)及零族的部分元素符号代码(阴影处为族序数)
如图是元素周期表中各主族(A)及零族的部分元素符号代码(阴影处为族序数)