题目内容
【题目】烟道气中的 NO 是主要的大气污染物之一,为了监测其含量,选用如下检测方法:将vL气样通入适量酸化的 H2O2 溶液中,恰好使 NO 完全被氧化成NO3-,加水稀释至 100.00mL。量取20.00mL该溶液,加入v1mLc1mol·L-1FeSO4标准溶液(过量),充分反应后,用c2 mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗 v2mL。回答下列问题:
(1)NO被H2O2氧化为NO3-的离子方程式为:_____。
(2)滴定过程中发生下列反应:
3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则气样中NO的物质的量为_______mol。
(3)下列操作会使 NO 测定结果偏高的是_____
A.滴定管未用标准液润洗
B.锥形瓶洗净后还存留少量的水
C.滴定管滴定前读数正确,滴定后俯视读数
D.FeSO4 标准溶液部分变质
【答案】2NO+3H2O2═2H++2NO3-+2H2O ![]() (c1v1-6c2v2)×10-3mol CD
(c1v1-6c2v2)×10-3mol CD
【解析】
(1)NO被H2O2氧化为NO3-,N元素的化合价升高,过氧化氢中O元素的化合价降低;
(2)由反应结合电子守恒可知存在Cr2O72-~6Fe2+~2NO3-,以此计算;
(3)A.滴定管未用标准液润洗,导致消耗K2Cr2O7标准溶液体积增大,使测定剩余亚铁离子偏高;
B.锥形瓶洗净后还存留少量的水,对整个测定结果无影响;
C.滴定管滴定前读数正确,滴定后俯视读数,导致消耗K2Cr2O7标准溶液体积减小,使测定剩余亚铁离子偏低;
D.FeSO4标准溶液部分变质,会导致测定剩余亚铁离子偏低。
(1)NO被H2O2氧化为NO3-的离子方程式是2NO+3H2O2═2H++2NO3-+2H2O;
(2)n(Cr2O72-)=c2v2×10-3mol,由Cr2O72-~6Fe2+可知过量的Fe2+为6c2v2×10-3mol,则与量取的20.00mL溶液中NO3-反应的Fe2+为c1v1×10-3mol-6c2v2×10-3mol=(c1v1-6c2v2)×10-3mol,由3Fe2+~NO3-可知100.00mL原溶液中NO3-为![]() ×(c1v1-6c2v2)×10-3mol×
×(c1v1-6c2v2)×10-3mol×![]() ═
═![]() (c1v1-6c2v2)×10-3mol,根据氮元素守恒:n(NO2)=n(NO3-)=
(c1v1-6c2v2)×10-3mol,根据氮元素守恒:n(NO2)=n(NO3-)=![]() (c1v1-6c2v2)×10-3mol;
(c1v1-6c2v2)×10-3mol;
(4)A.滴定管未用标准液润洗,导致消耗K2Cr2O7标准溶液体积增大,使测定剩余亚铁离子偏高,测定含N量偏低,则使NOx含量测定结果偏低,故A错误;
B.锥形瓶洗净后还存留少量的水,对整个测定结果无影响,故B错误;
C.滴定管滴定前读数正确,滴定后俯视读数,导致消耗K2Cr2O7标准溶液体积减小,使测定剩余亚铁离子偏低,由3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O中测定含N量偏高,则使NOx含量测定结果偏高,故C正确;
D.FeSO4标准溶液部分变质,会导致测定剩余亚铁离子偏低,3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O中测定含N量偏高,则使NOx含量测定结果偏高,故D正确;
故答案为:CD。

【题目】氮的氧化物是严重的大气污染物,可以通过以下方法处理:
Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应: 2NO(g)+2CO(g)N2(g)+2CO2(g)
(1)已知N2(g)+O2(g)2NO(g) △H=+180kJ/mol
化学键 | O=O | C=O | C≡O |
键能(kJ/mol) | 497 | 803 | 1072 |
则反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=_____kJ/mol。
(2)在一定温度下,向体积为1L的密闭容器中充入2molNO、1molCO,10分钟时反应2NO(g)+2CO(g)N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图所示:
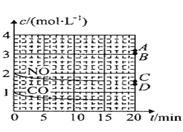
①该反应的平衡常数 K 的计算式为_____;前 10 分钟内用氮气表示的反应速率为_____。
②若保持温度不变,15 分钟时再向该容器中充入1.6molNO、0.4molCO2,则此时反应的ν正______ν逆(填“>”、“=”或“<”)。
③若保持其他条件不变,15min 时压缩容器的体积至 0.5L,20 分钟时反应重新达到平衡,NO 的浓度对应的点应是图中的_____(填字母)。
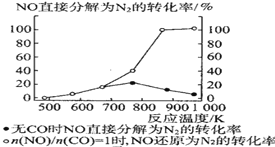
④某科研小组研究发现以 Ag-ZSM-5 为催化剂,NO 转化为 N2 的转化率随温度变化情况如图所示。若不使用 CO,温度超过775K,发现NO的分解率降低,其可能的原因是__________________
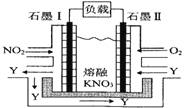
Ⅱ.利用电化学原理,将 NO2、O2和熔融 KNO3制成燃料电池,其原理如图,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅰ附近发生的反应电极反应式为_____相同条件下,消耗的 O2和 NO2的体积比为_____