题目内容
16.用质量分数为37.5%的浓盐酸(密度为1.16g/cm3)配制成1mol/L的稀盐酸.现实验室仅需要这种盐酸220mL.试回答下列问题:(1)配制稀盐酸时,应选用容量为250mL的容量瓶;
(2)经计算需要21.0mL浓盐酸,在量取时宜选用下列量筒中的C.
A.5mL B.10mL C.25mL D.50mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸其温度与室温一致后,沿玻璃棒注入250mL容量瓶中.
②往容量瓶中小心加蒸馏水至液面接近环形标线2~3cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切.
③在盛盐酸的烧杯中注入蒸馏水几十毫升,并用玻璃棒搅动,使其混合均匀.
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
上述操作中,正确的顺序是(填序号)③①④②.
(5)配制完后,应将容量瓶中的稀盐酸转移到干燥洁净的试剂瓶中存放,盖好塞子并贴上标签.
分析 (1)容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,据此选择;
(2)先计算出浓盐酸的物质的量浓度为c=$\frac{1000ρω%}{M}$,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;根据“大而近”的原则,根据需要量取的浓盐酸的体积来选择合适的量筒;
(3)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序.
解答 解:(1)容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,常用的规格有100mL、250mL、500mL、1000mL,现在需要这种盐酸220 mL,故应选用250mL容量瓶,故答案为:250;
(2)浓盐酸的物质的量浓度为c=$\frac{1000ρω%}{M}$=$\frac{1000×1.16×37.5%}{36.5}$=11.9mol/L,设需要浓盐酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:11.9mol/L×VmL=1mol/L×250mL
解得V=21.0mL.
根据“大而近”的原则,根据需要量取的浓盐酸的体积为21.0mL来选择合适的量筒,故应选择25mL量筒,故答案为:21.0;C;
(3)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序可有:③①④②;故答案为:③①④②.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
6.把1mol饱和一元醇分成两等份,其中一份充分燃烧生成1.5molCO2,另一份与金属钠充分作用,在标准状况下生成5.6LH2,该醇可能是( )
| A. | CH3CH2OH | B. | CH3CH2CH2OH | C. | CH3OH | D. | CH3CH2CH(CH3)OH |
1.下列说法正确的是( )
| A. | NaHSO4在熔融状态下的电离方程式为NaHSO4═Na++H++SO42- | |
| B. | H2CO3是弱酸,故Na2CO3是弱电解质 | |
| C. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| D. | NaHCO3在水溶液中的电离:NaHCO3═Na++HCO3-、HCO3-?H++CO32- |
8.假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化.①~⑧为各装置中的电极编号.下列说法错误的是( )
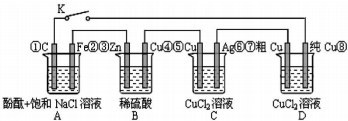

| A. | 当K闭合时,A装置发生吸氧腐蚀,在电路中做电源 | |
| B. | 当K断开时,B装置锌片溶解,有氢气产生 | |
| C. | 当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→② | |
| D. | 当K闭合后,A、B装置中pH均变大 |
5.下列说法正确的是( )
| A. | 淀粉、纤维素都属于纯净物 | B. | 金属氧化物都是碱性氧化物 | ||
| C. | 食醋、纯碱、食盐分别属于酸、碱、盐 | D. | 酸性氧化物不一定与水反应生成酸 |
6.化学与生产、生活、社会密切相关.下列说法正确的是( )
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 水泥、玻璃、青花瓷、水晶、玛瑙、分子筛都属于硅酸盐工业产品 | |
| C. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| D. | 通入过量的空气,可以使燃料充分燃烧,同时提高热量的利用率 |