题目内容
7.实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl:用水溶解,滤去残渣,滤液酸化后,K2MnO4转化为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4.请回答:(1)软锰矿制备K2MnO4的化学方程式是3MnO2+6KOH+KClO3$\frac{\underline{\;高温\;}}{\;}$3K2MnO4+KCl+3H2O.
(2)K2MnO4制备KMnO4的离子方程式是3MnO42-+4H+═MnO2↓+2MnO4-+2H2O.
(3)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2该反应的离子方程式是:2MnO4-+16H++5C2O42-$\frac{\underline{\;\;△\;\;}}{\;}$2Mn2++10CO2↑+8H2O.
分析 (1)根据反应物与生成物来书写反应方程式,即由软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl来书写;
(2)根据反应物与生成物来书写反应方程式,即由滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4来书写;
(3)根据KMnO4能与热的经硫酸化的Na2C2O4反应生成Mn2+和CO2,并利用质量守恒定律、电荷守恒来书写离子反应方程式.
解答 解:(1)由软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,则反应为3MnO2+6KOH+KClO3$\frac{\underline{\;高温\;}}{\;}$3K2MnO4+KCl+3H2O,
故答案为:3MnO2+6KOH+KClO3$\frac{\underline{\;高温\;}}{\;}$3K2MnO4+KCl+3H2O;
(2)由滤液酸化后,K2MnO4转变为MnO2和KMnO4,则反应为3MnO42-+4H+═MnO2↓+2MnO4-+2H2O,
故答案为:3MnO42-+4H+═MnO2↓+2MnO4-+2H2O;
(3)由KMnO4能与热的经硫酸化的Na2C2O4反应生成Mn2+和CO2,则反应为2KMnO4+5Na2C2O4+8H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O,离子方程式是:2MnO4-+16H++5C2O42-$\frac{\underline{\;\;△\;\;}}{\;}$2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+16H++5C2O42-$\frac{\underline{\;\;△\;\;}}{\;}$2Mn2++10CO2↑+8H2O.
点评 本题考查了化学反应方程式、离子反应方程式的书写,明确反应物与生成物及物质之间的关系是解答的关键,题目难度不大.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | 用试管取出试剂瓶中的K2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中 | |
| B. | Cu(NO3)2溶于水,可将含有Cu(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 | |
| D. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 |
| A. | O2在负极发生还原反应,且电极反应为:O2+2H2O+4e-═4OH- | |
| B. | 放电后KOH溶液的浓度将减小 | |
| C. | 当有22.4L(标准状况下)的H2参加反应时,电解质溶液中将通过2mol电子 | |
| D. | 供电时的总反应的化学方程式为:2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O |
| A. | 在c(HCO3-)=0.1 mol•L-1的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 在由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Fe2+、ClO-、Na+、SO42- | |
| C. | 在加入镁粉产生气体的溶液中:SO42-、NO3-、Na+、Fe2+ | |
| D. | 在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ |
| A. | pH=1的透明溶液中:Na+、MnO4-、K+、NO3- | |
| B. | 加入足量Na2O2之后的溶液:Cl-、K+、Fe3+、SO42- | |
| C. | 水电离出的c(OH-)=1×10-13mol/L的溶液中:NO3-、NH4+、CO32-、K+ | |
| D. | 能使淀粉碘化钾试纸变蓝的溶液中:Na+、SO32-、NH4+、Br- |
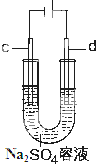 在25℃时,将一根石墨棒和一根铁棒做两电极分别插入一定量的硫酸钠饱和溶液中进行电解(见图),
在25℃时,将一根石墨棒和一根铁棒做两电极分别插入一定量的硫酸钠饱和溶液中进行电解(见图),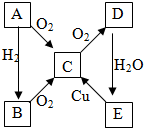 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.