题目内容
4.下列五种物质中 ①Ne ②HI ③H2O2④KOH ⑤Na2O ⑥Na2O2,只存在极性键的是②,既存在非极性键又存在离子键的是⑥,不存在化学键的是①;(填写序号)分析 不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,活泼金属和活泼非金属元素之间易形成离子键,单原子分子构成的物质中不含化学键.
解答 解:不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,活泼金属和活泼非金属元素之间易形成离子键,单原子分子构成的物质中不含化学键,①Ne中不含化学键、②HI中只含极性键、③H2O2中H-O原子之间存在极性键、O-O原子之间存在非极性键,④KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,⑤Na2O中只含离子键、⑥Na2O2中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,所以只存在极性键的是②,既存在非极性键又存在离子键的是⑥、不存在化学键的是①,
故答案为:②;⑥;①.
点评 本题考查化学键判断,侧重考查基本概念,明确物质构成微粒及微粒之间作用力是解本题关键,注意单原子分子中不存在化学键,为易错点.

练习册系列答案
相关题目
15.氢氧燃料电池已用于航天飞机,这种电池在使用时以30% KOH溶液为电解质溶液:据此作出判断,下列说法中正确的是( )
| A. | O2在负极发生还原反应,且电极反应为:O2+2H2O+4e-═4OH- | |
| B. | 放电后KOH溶液的浓度将减小 | |
| C. | 当有22.4L(标准状况下)的H2参加反应时,电解质溶液中将通过2mol电子 | |
| D. | 供电时的总反应的化学方程式为:2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O |
13.由两种金属组成的混合物13g,加入足量的稀硫酸可得到标准状况下气体11.2L,这两种金属不可能是( )
| A. | Al和Fe | B. | Mg和Fe | C. | Zn和Mg | D. | Mg和Al |
14.由硫酸钾、硫酸铝钾和硫酸组成的混合溶液,其pH=1,c(K+)=0.3mol•L-1,c(SO42-)=0,8mol•L-1,则c(Al3+)为( )
| A. | 0.15 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.4 mol•L-1 |
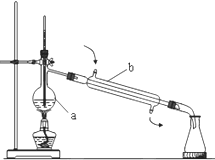 (1)写出如图石油的蒸馏装置中所指仪器的名称:
(1)写出如图石油的蒸馏装置中所指仪器的名称: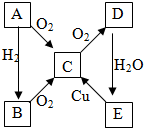 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.