题目内容
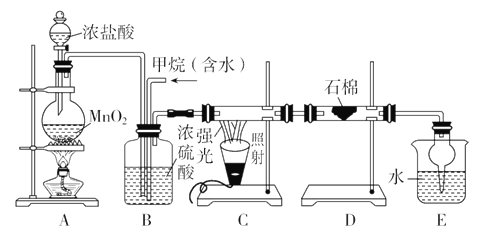
【题目】利用下图所示装置及药品制取氨气。

(1)A中制氨气的化学方程式是______。
(2)B中碱石灰的作用是______。
(3)C处是用集气瓶收集氨气的装置,请绘出装置图。______
(4)证明氨气已集满的操作和现象是______。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 干燥NH3
CaCl2+2NH3↑+2H2O 干燥NH3 ![]() 将湿润的红色石蕊试纸靠近C右侧的导管口,试纸变成蓝色
将湿润的红色石蕊试纸靠近C右侧的导管口,试纸变成蓝色
【解析】
(1)该实验用氯化铵和氢氧化钙加热生成氨气;
(2)氨气中混有水蒸气,可用碱石灰吸收水蒸气;
(3)氨气用向下排空气法的收集;
(4)可用湿润的红色石蕊(或酚酞)试纸,或将蘸有浓盐酸的玻璃棒证明氨气已集满。
(1)由装置图可知,该实验用氯化铵和氢氧化钙加热生成氨气,反应的 化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)氨气为碱性气体,反应过程中产生水,氨气中混有水蒸气,可用碱石灰吸收水蒸气,故答案为:干燥NH3;
(3)由于氨气密度比空气小、易溶于水,所以不能采用排水法收集,只能用向下排空气法的收集,故答案为:![]() ;
;
(4)氨气溶于水溶液显碱性,将湿润的红色石蕊试或酚酞试纸靠近C右侧的导管口,若试纸变成蓝色或变红(或将蘸有浓盐酸的玻璃棒靠近C右侧的导管口,若有大量白烟生成),说明氨气已集满,故答案为:将湿润的红色石蕊试纸靠近C右侧的导管口,试纸变成蓝色。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案【题目】减少氮氧化物和硫氧化物在大气 中的共放是环境保护的重要内容之一。
(1).已知:N2(g)+O2(g)=2NO (g) △H=+180.5kJ/mol
C(s )+ O2(g)=CO2(g) △H =-393.5kJ/mo1
2C(s)+ O2(g) =2CO(g) △H=-221kJ/mol
若某反应平衡常数表达式为: k=[c(N2)·c2(CO2)]/[c2(NO)·c2(CO)],请写出此反应的热化学方式________________________。
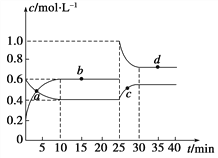
(2)N2O4在一定条件下可发生分解: 2 N2O5(g)![]() 4NO2(g) +O2 (g)。某温度下测得恒容密闭容器中N2O4浓度随时间的变化如下表:
4NO2(g) +O2 (g)。某温度下测得恒容密闭容器中N2O4浓度随时间的变化如下表:
t /min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N0)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为P0第3.00min时体系压强为P1,则P1:P0 =__________2.00min~5.00min 内,O2的平均反应速率为________________。
②一定温度下,在恒容密闭容器充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________。
a.容器中压强不再变化 b.NO2和O2 的体积比保持不变
c.2V正( NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2.且保持不变
(3)活性炭还原NO2的反应为: 2NO2(g)+2C (s)![]() N2(g)+2CO2(g),在恒温条件下,1mo1NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质量浓度与平衡总压的关系如图所示:①A、B、C 三点中NO2的转化率最高约是_____点(填“A”、“B”或“C”)。
N2(g)+2CO2(g),在恒温条件下,1mo1NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质量浓度与平衡总压的关系如图所示:①A、B、C 三点中NO2的转化率最高约是_____点(填“A”、“B”或“C”)。
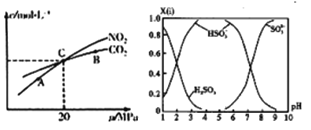
②计算C点时该反应的压强平衡常数Kp=_________MPa (K用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)直接排放含SO2的烟气会形成酸雨,危害环境。可月NaOH吸收,所得含硫各微粒(H2SO3 、HSO3-利SO32- )存在于反应后的溶被中,它们的物质量分数X(i)与溶液pH的关系如图所示。
若是与0.lmol/LNaOH 反应后的溶液,现得溶液为pH=8时,溶液中各离子浓度由大到小的顺序是____________________。
(5)实验狈得NH4HSO3溶液中,![]() ,则溶液的pH为_____;向该溶液中加氨水使溶液呈中性时,
,则溶液的pH为_____;向该溶液中加氨水使溶液呈中性时,![]() =______________。(已知: H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
=______________。(已知: H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。