题目内容
氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。

反应①②③为________反应(填“吸热”或“放热”)。
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________。
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①某温度下,向容积为10 L的密闭容器中通入2 mol NH3和1 mol CO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K=______。该温度下平衡常数K的计算结果为_____。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是________。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。

反应①②③为________反应(填“吸热”或“放热”)。
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________。
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。①某温度下,向容积为10 L的密闭容器中通入2 mol NH3和1 mol CO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K=______。该温度下平衡常数K的计算结果为_____。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是________。
| A.提高NH3的浓度 | B.增大压强 |
| C.及时转移生成的尿素 | D.使用更高效的催化剂 |
(1)放热 CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+161.1 kJ·mol-1
(2)①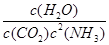 100 L2·mol-2 ②AB
100 L2·mol-2 ②AB
(2)①
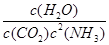 100 L2·mol-2 ②AB
100 L2·mol-2 ②AB (1)由化学反应的能量变化图可知反应①②③中产物能量都小于反应物能量,故都是放热反应;反应③-①-②×3即可得到CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+161.1 kJ·mol-1。
(2)① 2NH3(g)+CO2(g)? ?CO(NH2)2(l)+H2O(g)
?CO(NH2)2(l)+H2O(g)
初始浓度
(mol·L-1) 0.2 0.1 0 0
转化浓度
(mol·L-1) 0.1 0.05 0.05 0.05
平衡浓度
(mol·L-1) 0.1 0.05 0.05 0.05
K=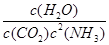 =100 L2·mol-2。
=100 L2·mol-2。
②该反应条件下尿素是液体,改变尿素的量,平衡不移动。
(2)① 2NH3(g)+CO2(g)?
 ?CO(NH2)2(l)+H2O(g)
?CO(NH2)2(l)+H2O(g)初始浓度
(mol·L-1) 0.2 0.1 0 0
转化浓度
(mol·L-1) 0.1 0.05 0.05 0.05
平衡浓度
(mol·L-1) 0.1 0.05 0.05 0.05
K=
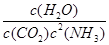 =100 L2·mol-2。
=100 L2·mol-2。②该反应条件下尿素是液体,改变尿素的量,平衡不移动。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


 2H2↑+O2↑
2H2↑+O2↑ 2H2↑+O2↑
2H2↑+O2↑ 2H2↑+O2↑
2H2↑+O2↑ CO+3H2
CO+3H2 CH3OH(g)+H2O(g) ΔH="-49.0" kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH="-49.0" kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
 CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:



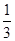 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
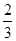 Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在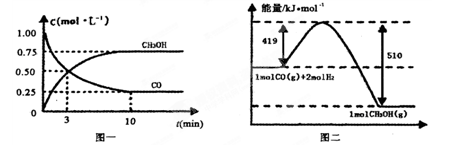
 H2(g)+
H2(g)+
 ,它所对应反应的化学方程式为 。
,它所对应反应的化学方程式为 。 CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1