��Ŀ����
����Ŀ����ͼ��ʾ����װ�ÿ�������ȡ�۲�Fe(OH)2�ڿ����б�����������ɫ�仯��ʵ��ʱ����ʹ����м��6molL-1�����ᣬ�����Լ���ѡ����д���пհף�

��1��B��ʢ��һ������NaOH��Һ��A��ӦԤ�ȼ����ҩƷ��__��A�з�Ӧ�����ӷ���ʽ��__��
��2��ʵ�鿪ʼʱ�Ƚ�����a__(����رա�)��
��3����������Fe(OH)2�IJ������̣�__��
��4��ʵ����ϣ���b������������һ���ֿ�������ʱBƿ�з����ķ�ӦΪ__��
��5�����и�ͼʾ�У�___�ܽϳ�ʱ�俴��Fe(OH)2��ɫ������(�����)
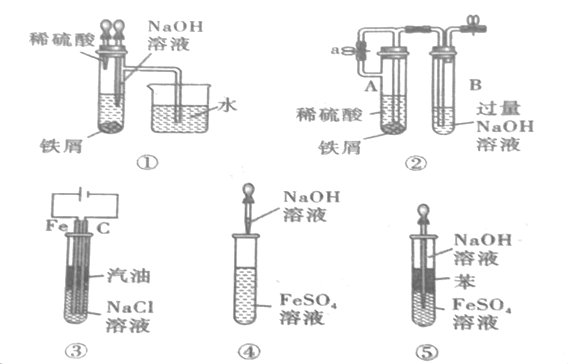
���𰸡���м Fe+2H+=Fe2++H2�� �� �رջ���a��ʹFeSO4��Һѹ��Bƿ�н��з�Ӧ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 �٢ڢۢ�
��������
��ȡ����������ʹ�õ��Լ�����������������������Һ������һ��Ҫע�����������������A�Dz�������������װ�ã���֤�����B�У�Ҫ��������������ѹǿ������ʵ���Լ��Լ�ԭ�����ش�������ɡ�
��1��B��ʢһ������NaOH��Һ����A�б����ṩ�������ӣ�����ӦԤ�ȼ�����Լ������ۣ�A�з�Ӧ�����ӷ���ʽ��Fe+2H+=Fe2++H2�����ʴ�Ϊ����м��Fe+2H+=Fe2++H2����
��2��Ϊ��ֹ���ɵ�����������������������Ҫ����ϡ���������Ӧ�����������ž�װ���еĿ��������������E������ɰ�ȫ�¹ʣ�����Ҫ����a��ʹ���ɵ��������װ��B��һ�����ܳ�ȥA��Bװ���еĿ�������һ�����ܷ�ֹ��ȫ�¹ʵķ������ʴ�Ϊ����
��3���������ᷴӦ���������ɣ��رջ���a������Aװ������������ʹFeSO4��Һ��ѹ��Bƿ�н��з�Ӧ�����������������ʴ�Ϊ���رջ���a��ʹFeSO4��Һѹ��Bƿ�н��з�Ӧ��
��4���������������ȶ������ױ������е������������ɺ��ɫ��������������Ӧ����ʽΪ��4Fe(OH)2+O2+2H2O=4Fe(OH)3���ʴ�Ϊ��4Fe(OH)2+O2+2H2O=4Fe(OH)3��
��5���Ա�5��ʵ�����Կ��Է���ѡ��ۡ��ݼ����л����������Ϳ����Ӵ��٣�����Fe��ϡ���������������ų�װ���е�����������Ҳ�ܼ����������Ӵ�������ʢ������������Һ�ĵι�������л�ԭ�����۵�����������Һ�У����Ա����Թ��в������������������������������ܼ����������Ӵ���ֻ�Т����ɵ������������ܹ������������������Ӧ��4Fe(OH)2+O2+2H2O=4Fe(OH)3�����²��ܳ�ʱ��۲쵽�������������ʴ�Ϊ���٢ڢۢݡ�




