题目内容
2.若20g密度为ρ g•cm-3的Ca(NO3)2溶液中含有2g Ca(NO3)2,则溶液中NO3-的物质的量浓度为( )| A. | $\frac{ρ}{400}$mol•L-1 | B. | $\frac{20}{ρ}$mol•L-1 | C. | $\frac{50ρ}{41}$mol•L-1 | D. | $\frac{25ρ}{41}$mol•L-1 |
分析 先计算出该硝酸钙溶液中溶质的质量分数,然后根据c=$\frac{1000ρω}{M}$mol/L计算出该溶液中硝酸钙的物质的量浓度,再结合硝酸钙的化学式计算出溶液中硝酸根离子的浓度.
解答 解:该硝酸钙溶液中溶质的质量分数为:$\frac{2g}{20g}$×100%=10%,
则该溶液中硝酸钙的物质的量浓度为:c=$\frac{1000ρω}{M}$mol/L=$\frac{1000×10%×ρ}{164}$mol/L=$\frac{25ρ}{41}$mol/L,
所以溶液中NO3-的物质的量浓度为:c(NO3-)=2c[Ca(NO3)2]=$\frac{25ρ}{41}$mol/L×2=$\frac{50ρ}{41}$mol/L,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度与溶质质量分数的关系为解答关键,注意掌握物质的量浓度的概念及计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12. 某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
 某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )| A. | 反应开始至2min,Z的反应速率为0.10mol•L-1•min-1 | |
| B. | 该反应的化学方程式为3X+Y?2Z | |
| C. | 2min时,反应达最大限度,但化学反应仍在进行 | |
| D. | 反应达到平衡时,压强是开始时的0.9倍 |
10.在某酸性溶液中,一定能大量共存的离子组是( )
| A. | Na+、K+、SO42-、HCO3- | B. | NH4+、K+、SO42-、Cl- | ||
| C. | Na+、Al3+、AlO2-、NO3- | D. | Fe2+、K+、S042-、NO3- |
17.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol/L,用石墨作电极电解此溶液,当通电一段时间后(假设溶液体积不变),两极均收集到22.4L气体(标准状况).下列说法正确的是( )
| A. | 上述电解过程中铜转移2mol电子 | B. | 电解后溶液中c(H+)为4mol/L | ||
| C. | 电解得到的Cu的物质的量为0.5mol | D. | 原混合溶液中c(K+)为1mol/L |
1.下列关于分类的说法正确的是( )
| A. | 活性炭、C60、金刚砂都是碳的同素异形体 | |
| B. | Fe2O3、Na2O2、K2O都是碱性氧化物 | |
| C. | 淀粉、蛋白质、油脂都属于有机高分子化合物 | |
| D. | 纯碱、氯化铵、明矾都是盐且都属于强电解质 |
5.下列说法不正确的是( )
| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全灭活该病毒感染性,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | 2015年初公益调查《柴静雾霾调查:穹顶之下》发布,引起社会强烈反响.雾霾中PM2.5属于胶体 | |
| C. | 分光光度计可以用来测定某些化学反应的反应速率 | |
| D. | 汽油、煤油、植物油都是油,但它们的主要成分不相同 |
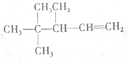 命名3,4,4-三甲基-1-戊烯
命名3,4,4-三甲基-1-戊烯
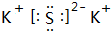 .
.