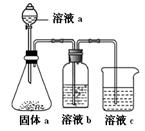
题目内容
A、B、M、D、E是原子序数依次增大的五种短周期元素。A元素的一种原子中不含中子。B、M、D、E分别在下表(周期表的一部分)不同的空格内占有相应的位置,E的原子序数是D的原子序数的2倍。试回答: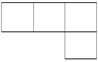
(1)A元素是________ 。
(2)在B、M、D、E四种元素的最简单氢化物中,沸点最高的是__________(填化学式)。
(3)A、B、M、D可组成多种18电子分子,写出 2种具有18电子的有机物的结构简式______、______。
(1)A是氢或H (2)H2O (3)CH3—CH3 CH3OH 、CH3F、CH3NH2等。
解析试题分析:根据题意可知A:H;B:C;M:N;D:O;E:S。(1)A元素是A是氢或H。(2)这四种元素的最简单氢化物都是分子晶体,分子之间以分子间作用力结合。分子间作用力越大,克服分子间作用力使物质融化或汽化消耗的能量就越多,物质的熔沸点就越高。而分子间作用力与物质的相对分子质量有关。物质的相对分子质量越大,分子间作用力就越大。熔沸点也就越高。但是在水分子之间、氨气的分子之间还都存在着一种叫氢键的相互作用力,增加了分子之间的相互作用,由于氢键:H2O>NH3,所以沸点H2O>NH3。在B、M、D、E四种元素的最简单氢化物中,沸点最高的是H2O。(3)A、B、M、D可组成有18电子有机物的结构简式为:CH3—CH3、CH3OH 、CH3F、CH3NH2等。
考点:考查元素的推断、氢化物沸点的比较、18电子的有机分子的结构简式的书写等知识。

W、M、N、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻;X的单质是一种常见的半导体材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大。
(1)元素X在周期表中的位置是_______________;元素Y的离子结构示意图为____________
(2)下列有关物质性质的比较中.正确的是________________
| A.M、X、Z形成的单质熔沸点 M>X>Z |
| B.氢化物的热稳定性:W>X |
| C.X分别与W和Z形成的化合物中化学键类型,晶体类型均相同 |
| D.Z元素含氧酸的酸性一定强于Y元素的含氧酸 |
(4)X、Z与氢三种元素按1:2:2形成的五原子化合物属于_______分子(填 “极性” “非极性”)
(5)与Z同族的元素都能形成氢化物,其中水溶性最强的是______(填化学式)
(6)含有N元素的两种常见离子能发生双水解反应,试写出该离子方程式 ________________。
X、Y、Z、W是元素周期表中前30号元素,且原子序数依次增大。其相关信息如下表:
| 元素 | 相关信息 |
| X | X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z元素的最高正价与负价代数和为6 |
| W | W基态原子未成对电子数是前30号元素中最多的 |
(1)W位于元素周期表第 周期第 族,其基态原子最外层有 个电子。
(2)X的第一电离能比Y的 (填“大”或“小”),1mol X22-中含有的
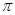 键数目为 。
键数目为 。(3)X和Y的气态氢化物中,较稳定的是 (写化学式),Y的同族元素(包括Y)的最简单氢化物中沸点最低的是 。
(4)写出KZY3与HZ浓溶液反应制取Z2的化学方程式,并标出电子转移的方向和数目 。
(5)已知:X(s)+Y2(g)=XY2(g) ΔH 1= -393.5 kJ?mol-1
XY(g) +1/2Y2(g)=XY2(g) ΔH 2= -282.9 kJ?mol-1
则X(s)与Y2(g)反应生成XY(g)的热化学反应方程式为 。