题目内容
A、B、C、D四种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的价电子排布为ns2πp2n,D在空气中燃烧可以得到淡黄色固体。又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体。请回答下列问题:
(1)D在元素周期表中的位置是 。
(2)比较元素B和C的第一电离能:B C(填“大于”、“小于”或“不确定”),将BA3通入溴水中可发生反应,生成B的单质和一种盐Y,B的单质中的σ键和π键个数比为 ,盐Y的晶体类型是 。
(3)D与A形成的粒子个数比为1:1的简单化合物可与水反应生成A的单质,该反应的化学方程式为 。
(4)已知B2A4和过氧化氢混合可作火箭推进剂。12.8g液态B2A4与足量过氧化氢反应生成B的单质和气态水,放出256.65kJ的热量: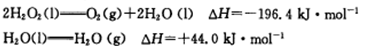
写出液态B2A4和氧气反应生成B的单质和液态A2C的热化学方程式 。
(1)第三周期IA族(2分)
(2)大于(2分) 2(2分) 离子晶体(2分)
(3)NaH+H2O=NaOH+H2↑ (2分)
(4)N2H4(l)+O2(g)=N2(g)+2H2O(l) △H="-621.2" kJ·mol-1(2分)
解析试题分析:由D在空气中燃烧得到淡黄色固体可知D为Na,再结合A、D同主族以及四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体可知,A一定为H,再结合B的价电子排布可推知B、C分别为N、O。(2)因N的2p轨道处于半充满的稳定状态,故第一电离能大于同周期相邻的氧元素;由氧化还原反应规律可得到盐Y为NH4 Br,属于离子晶体,在单质N2中存在氮氮三键,其中1个σ键和2个π键。(3)NaH与H2O发生归中反应得到H2与NaOH。(4)利用题给信息可知:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H=-641.6kJ/mol,然后利用“盖斯定律”结合已知热化学方程式进行变形即可。
考点:考查原子结构与性质以及共价键类型、热化学等。

W、M、N、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻;X的单质是一种常见的半导体材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大。
(1)元素X在周期表中的位置是_______________;元素Y的离子结构示意图为____________
(2)下列有关物质性质的比较中.正确的是________________
| A.M、X、Z形成的单质熔沸点 M>X>Z |
| B.氢化物的热稳定性:W>X |
| C.X分别与W和Z形成的化合物中化学键类型,晶体类型均相同 |
| D.Z元素含氧酸的酸性一定强于Y元素的含氧酸 |
(4)X、Z与氢三种元素按1:2:2形成的五原子化合物属于_______分子(填 “极性” “非极性”)
(5)与Z同族的元素都能形成氢化物,其中水溶性最强的是______(填化学式)
(6)含有N元素的两种常见离子能发生双水解反应,试写出该离子方程式 ________________。
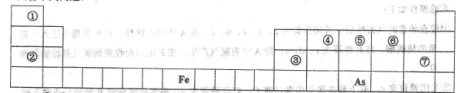
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下列问题:
| 族周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | ⑧ | ⑨ | |
(2)④⑤⑧形成的简单离子半径由大到小的顺序为_______________(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为____(填化学式)。
(3)⑤和⑨形成化合物的晶体类型为__________。
(4)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是___________(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式__________。
(5)X、Y由①②④中的两种或三种元素组成。X的溶液能与小苏打反应产生Y,若X是其所属系列中最简单的分子,且相对分子质量为46,则X的名称为 ,写出X溶液与小苏打反应的化学方程式为_______________。
下表中所列的字母分别代表某一化学元素。完成下列填空:
| a | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | b | | |
| c | | | | | | | | | | | | d | | | e | f | |
| | | | | | | | | | | | | | g | | | | |
| | | | | | | | | | | | | | | | h | | |
| | i | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
(1)h的最外层有____种运动状态的电子。a、b、c三种元素形成的化合物电子式为________。
(2)d单质溶于i的最高价氧化物对应水化物的溶液时发生反应的离子方程式为____________。
(3) 元素e与f元素相比,非金属性较强的是__________(写元素符号),下列表述中能证明这一事实的是__________(选填序号)。
a. e的阴离子还原性强于f的阴离子 b. f的氢化物酸性强于e的氢化物
c. e单质的熔点高于f单质 d. e和f形成的化合物中,e显正价,f显负价
(4)元素X(非a~i元素)是所在周期原子半径最大的非金属元素,它的气态氢化物为三角锥形极性分子,写出X在周期表中的位置_______________________________。