题目内容
工业上生产硫酸的流程图如下: 
请回答下列问题:
(1)早期生产硫酸以黄铁矿为原料,但现在工厂生产硫酸以硫黄为原料,理由是 。
(2)在气体进入催化反应室前需净化的原因是 。
(3)在催化反应室中通常使用常压,在此条件下SO2的转化率为90%。但是部分发达国家采取高压条件下制取SO3,采取加压措施的目的除了加快反应速率外,还可以 ,从而提高生产效率 。
(4)工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染,废物利用的目的。用化学方程式表示其反应原理: 。
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是 。 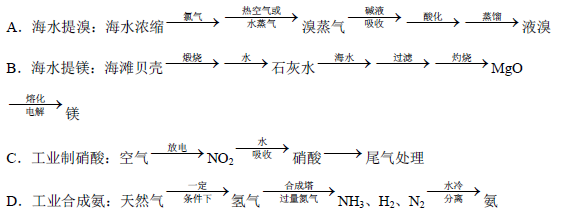
(1)以黄铁矿为原料的生产中产生的废弃物太多,处理成本高(2)防止催化剂中毒(3)使平衡向正方向移动;有利于提高SO2的转化率(4)SO2+NH3+H2O=NH4HSO3;NH4HSO3+H2SO4=(NH4)2SO4+2H2O+2SO2↑或SO2+2NH3+H2O=(NH4)2SO3;(NH4)2SO3+H2SO4=(NH4)2SO4+H2O+SO2↑(5)A D
解析试题分析:(1)黄铁矿的主要成分为FeS2,以黄铁矿为原料的生产中产生的废弃物太多,处理成本高使得现在工厂生产硫酸以硫黄为原料(2)以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收;其中二氧化硫的催化氧化在催化剂表面和空气中的氧气接触反应,若气体中含有杂质气体容易使催化剂中毒,所以煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥;故答案为:接触室,防止催化剂中毒(3)由题意知反应方程式2SO2(g)+O2(g) 2SO3(g),在常压下,SO2的转化率约为90%,采用高压条件,可以使化学反应速率加快,并且化学平衡向着生成三氧化硫的方向进行,可以提高生产效率,提高经济效益,故答案为使平衡向正方向移动;有利于提高SO2的转化率(4)工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收,再用浓硫酸处理,先用氨水吸收时,发生反应:SO2+2NH3?H2O═(NH4)2SO3或SO2+2NH3+H2O=(NH4)2SO3,再用浓硫酸处理时,发生反应:(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O或(NH4)2SO3+H2SO4=(NH4)2SO4+H2O+SO2↑,以达到消除污染、废物利用的目的(5)A、海水提溴的方法正确;B、海水提镁主要通过电解氯化镁完成,基本流程如下:海水-(结晶)-母液-(石灰乳)-Mg(OH)2-(加盐酸,浓缩,结晶)-MgCl2晶体-(脱水)-MgCl2-(电解)-Mg,故B错误;C、空气放电生成二氧化氮反应成本太高而且产物不稳定,工业制硝酸主要流程是将氨和空气的混合气(氧:氮≈2:1)通入灼热(760~840℃)的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮(NO)。生成的一氧化氮利用反应后残余的氧气继续氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸,故C错误;D、工业制备氨气流程正确;故答案为A D。
2SO3(g),在常压下,SO2的转化率约为90%,采用高压条件,可以使化学反应速率加快,并且化学平衡向着生成三氧化硫的方向进行,可以提高生产效率,提高经济效益,故答案为使平衡向正方向移动;有利于提高SO2的转化率(4)工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收,再用浓硫酸处理,先用氨水吸收时,发生反应:SO2+2NH3?H2O═(NH4)2SO3或SO2+2NH3+H2O=(NH4)2SO3,再用浓硫酸处理时,发生反应:(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O或(NH4)2SO3+H2SO4=(NH4)2SO4+H2O+SO2↑,以达到消除污染、废物利用的目的(5)A、海水提溴的方法正确;B、海水提镁主要通过电解氯化镁完成,基本流程如下:海水-(结晶)-母液-(石灰乳)-Mg(OH)2-(加盐酸,浓缩,结晶)-MgCl2晶体-(脱水)-MgCl2-(电解)-Mg,故B错误;C、空气放电生成二氧化氮反应成本太高而且产物不稳定,工业制硝酸主要流程是将氨和空气的混合气(氧:氮≈2:1)通入灼热(760~840℃)的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮(NO)。生成的一氧化氮利用反应后残余的氧气继续氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸,故C错误;D、工业制备氨气流程正确;故答案为A D。
考点:工业制取硫酸;化学平衡的影响因素;

化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。
请回答下列问题: (1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)??
(1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)??
CH3CH2OH(g)+H2O(g)。请写出该反应的化学平衡常数表达式K=________。
(2)常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
①上述盐溶液中的阴离子,结合质子能力最强的是________。
②根据表中数据,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是________(填字母);将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2SO4 D.CH3COOH E.H2CO3
③把CO2气体通入饱和碳酸钠溶液中,可以观察到的现象为________,原因为________(用离子方程式表示)。
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为____________。
(3)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是_______。

A.加入适量BaCl2(固体)可以使溶液由d点变到c点
B.通过加水稀释可以使溶液由b点变到a点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp等于c点对应的Ksp
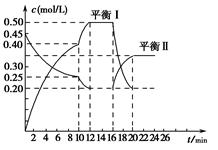
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示: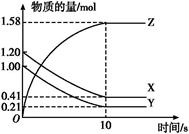
(1)从反应开始到10 s时,用Z表示的反应速率为 ,X的物质的量浓度减少了 ,Y的转化率为 。
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示: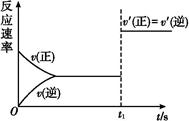
则下列说法符合该图像的是 。
| A.t1时刻,增大了X的浓度 | B.t1时刻,升高了体系温度 |
| C.t1时刻,缩小了容器体积 | D.t1时刻,使用了催化剂 |
据报道,在300 ℃、70 MPa 条件下,由CO2和H2合成乙醇已成为现实,该合成对解决能源问题具有重大意义。
(1)已知25 ℃、101 kPa条件下,1 g乙醇燃烧生成CO2和液态水时释放出a kJ能量,请写出该条件下乙醇燃烧的热化学反应方程式: 。
(2)由CO2和H2合成乙醇的化学方程式为2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
①正反应的ΔH 0(填“>”、“<”或“=”);
②该反应的化学平衡常数表达式为K= 。
(3)对于该化学平衡,为了提高H2的转化率,可采取的措施有 。
| A.升温 | B.加压 |
| C.加催化剂 | D.增加CO2的浓度 |
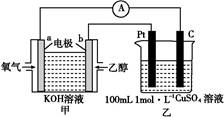
①b电极上发生的电极反应式为 。
②若甲中有0.1 mol CH3CH2OH参加反应,则乙装置中生成的气体在标准状况下的体积共为 L。
已知CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数随温度变化如下表:
CO(g)+H2O(g)的平衡常数随温度变化如下表:
| t/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
请回答下列问题:
(1)上述正向反应是________反应(选填“放热”或“吸热”)。
(2)能判断该反应达到化学平衡状态的依据是________。(填编号)
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2
D.混合气体的平均相对分子质量不变
E.混合气体的密度不变
(3)在850 ℃发生上述反应,以表中的物质的量投入恒容反应器中,其中向正反应方向进行的有________(选填A、B、C、D、E)。
| | A | B | C | D | E |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
(4)在850 ℃时,可逆反应:CO2(g)+H2(g)
 CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
CO(g)+H2O(g),在该容器内各物质的浓度变化如下:| 时间 /min | CO2 (mol·L-1) | H2 (mol·L-1) | CO (mol·L-1) | H2O (mol·L-1) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
则3 min~4 min平衡后c3=________mol·L-1,CO2的转化率为________。
金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用。
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。镁与盐酸反应的离子方程式为 ;在前4min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
| 编号 | 电极材料 | 电解质溶液 | 电子流动 方向 |
| 1 | Mg Al | 稀盐酸 | Mg流向Al |
| 2 | Mg Al | NaOH溶液 | |
根据上表中的实验现象完成下列问题:
①实验1中Mg为 极;
②实验2中电子流动方向 ,Al为 极,为什么? 。
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 | 平衡常数 | 焓变 | 起始总浓度 |
在水中,HA 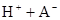 | 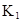 | 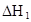 |  |
在苯中,2HA 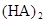 | 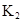 | 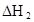 | 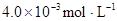 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1=___________。
(2)25℃,该水溶液的pH为___________,(已知:1g2=0.3,lg3=0.5)在苯体系中HA的转化率为___________。
(3)在苯中,HA发生二聚:2HA
 (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则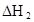 ___________0。
___________0。(4)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足
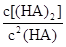 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。  H2↑+I2
H2↑+I2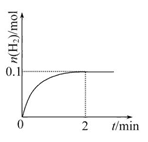
 yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题: