��Ŀ����
��֪CO2��g����H2��g�� CO��g����H2O��g����ƽ�ⳣ�����¶ȱ仯���±���
CO��g����H2O��g����ƽ�ⳣ�����¶ȱ仯���±���
| t/�� | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
��ش��������⣺
��1����������Ӧ��________��Ӧ��ѡ����ȡ������ȡ�����
��2�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������________�������ţ�
A��������ѹǿ����
B��c��CO2����c��CO��
C������a mol CO2��ͬʱ����a mol H2
D����������ƽ����Է�����������
E�����������ܶȲ���
��3����850 �淢��������Ӧ���Ա��е����ʵ���Ͷ����ݷ�Ӧ���У�����������Ӧ������е���________��ѡ��A��B��C��D��E����
| | A | B | C | D | E |
| n��CO2�� | 3 | 1 | 0 | 1 | 1 |
| n��H2�� | 2 | 1 | 0 | 1 | 2 |
| n��CO�� | 1 | 2 | 3 | 0.5 | 3 |
| n��H2O�� | 5 | 2 | 3 | 2 | 1 |
��4����850 ��ʱ�����淴Ӧ��CO2��g����H2��g��
 CO��g����H2O��g�����ڸ������ڸ����ʵ�Ũ�ȱ仯���£�
CO��g����H2O��g�����ڸ������ڸ����ʵ�Ũ�ȱ仯���£�| ʱ�� /min | CO2 ��mol��L��1�� | H2 ��mol��L��1�� | CO ��mol��L��1�� | H2O ��mol��L��1�� |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
��3 min��4 minƽ���c3��________mol��L��1��CO2��ת����Ϊ________��
��1�����ȡ���2��C����3��A����4��0.12��60%
����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д������ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2 , ��ѧ����ʽ���£�2NO + 2 CO 2CO2 + N2 ��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��£������崫������ò�ͬʱ���NO��COŨ�����±���
2CO2 + N2 ��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��£������崫������ò�ͬʱ���NO��COŨ�����±���
| ʱ�� /s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol��L��1 | 1.00��10��3 | 4.50��10��4 | 2.50��10��4 | 1.50��10��4 | 1.00��10��4 | 1.00��10��4 |
| c(CO)/mol��L��1 | 3.60��10��3 | 3.05��10��3 | 2.85��10��3 | 2.75��10��3 | 2.70��10��3 | 2.70��10��3 |
��ش𣺣����¸�����������¶ȱ仯�Դ�Ч�ʵ�Ӱ�죩��
��1��ǰ2s�ڵ�ƽ����Ӧ�ٶ�v (N2)�� ��
��2���ڸ��¶��£���Ӧ��ƽ�ⳣ��K�� ���������¶�ʱKֵ��С����÷�Ӧ�Ħ�H 0(��д����������������������)��
��3�����������з���������Ӧ����ƽ������д�ʩ�����NOת���ʵ���
A. ѡ�ø���Ч�Ĵ��� B. ���߷�Ӧ��ϵ���¶�
C. ���ͷ�Ӧ��ϵ���¶� D. ��С���������
��4���о���������ʹ�õ���������ʱ����������ȱ���������ѧ��Ӧ���ʡ�Ϊ�˷ֱ���֤�¶ȡ������ȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������Ա�ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�����������Ʊ��Ŀո�������ʣ���ʵ���������ݡ�
| ʵ���� | T / �� | NO��ʼŨ�� ( mol��L��1 ) | CO��ʼŨ�� ( mol��L��1 ) | �����ıȱ���� ( m2��g��1 ) |
| �� | 280 | 1.20 �� 10��3 | 5.80 �� 10��3 | 82 |
| �� | | | | 124 |
| �� | 350 | | | 124 |
����þ���仯���ﲻ���ڹ���������ҪӦ�ã��ڻ�ѧ�о���Ҳ�й㷺Ӧ�á�
��1��ijͬѧ�о���Ӧ����ʱ�����·�����ȡһ��þ������ɰֽ��ȥ���������Ĥ��ʹ����þ����һ�������ᷴӦ����H2�����뷴Ӧʱ��Ĺ�ϵ������ͼ��ʾ��þ�����ᷴӦ�����ӷ���ʽΪ ����ǰ4min�ڣ�þ��������ķ�Ӧ�����ӿ죬��4 min֮��Ӧ�����������������ԭ��_____________��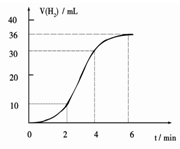
��2����������Mg(OH)2����Һ�м��������ı����Ȼ����Һ��������ȫ�ܽ⣬д��NH4Cl������ҺʹMg(OH)2����Һ�ܽ�����ӷ���ʽ ��
��3��Mg��Al���γ�ԭ���:
| ��� | �缫���� | �������Һ | ������������ |
| 1 | Mg��Al | ϡ���� | Mg����Al |
| 2 | Mg��Al | NaOH��Һ | |
�����ϱ��е�ʵ�����������������:
��ʵ��1��MgΪ ����
��ʵ��2�е����������� ��AlΪ ����Ϊʲô?����������������
��ҵ������Ĺ��������÷�Ӧ2SO2��g����O2��g��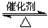 2SO3��g������H��0����SO2ת��ΪSO3��β��SO2����NaOH��Һ�������ա���ش��������⣺
2SO3��g������H��0����SO2ת��ΪSO3��β��SO2����NaOH��Һ�������ա���ش��������⣺
��1��һ�������£���һ���������ܱ������г���2molSO2��1molO2������Ӧ��������˵����ȷ���� ��
A������Ӧ����v(SO2)=v(SO3)�������˵���ÿ��淴Ӧ�Ѵﵽƽ��״̬
B�������¶Ⱥ�����������䣬����2 mol N2����ѧ��Ӧ���ʼӿ�
C��ƽ��������Ӧ��Ũ�ȣ���ƽ��һ�����ƣ�����Ӧ���ת����һ��������
D��ƽ����ƶ�����ѹ�����壬ƽ��ʱSO2��O2�İٷֺ�����С��SO3�İٷֺ�������
E�������¶Ⱥ�����������䣬ƽ����ٳ���2molSO3���ٴ�ƽ��ʱ�����Ũ�Ⱦ���ԭƽ��ʱ��Ũ�ȴ�
F��ƽ��������¶ȣ�ƽ�ⳣ��K����
��2����һ������SO2��g����O2��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У��ڲ�ͬ�¶��½��з�Ӧ�õ����±��е��������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0��8 | 6 |
| 2 | T2 | 4 | 2 | 0��4 | y | 9 |
��ʵ��1�ӿ�ʼ����Ӧ�ﵽ��ѧƽ��ʱ��v��SO2����ʾ�ķ�Ӧ����Ϊ ������y= ��
��T1 T2 ,(ѡ���������������=��),ʵ��2�д�ƽ��ʱ O2��ת����Ϊ ��
��3��β��SO2��NaOH��Һ���պ������Na2SO3�����г�����0��1mol/LNa2SO3��Һ��ʵ��ⶨ��pHԼΪ8������������⣺
�ٸ���Һ��c��Na+���� c��OH-��֮��Ϊ ��
�ڸ���Һ��c��OH-��= c��H+��+ + ������Һ����������Ũ�ȱ�ʾ����
�۵������Һ�м�������NaOH����ʱ��c��SO32-�� ,c��Na+�� ����ѡ���������С�����䡱��
��4������ú������ʵ������ʵ����и���Һ�ֱ�������SO2���������������ɶൽ�ٵ�˳���� ��
A��Na2CO3 B��Ba(NO3)2 C��Na2S D������KMnO4

 2NH3 ��H<0���������¶Ȳ��䣬ij��ȤС��ͬѧ��÷�Ӧ������������ѹǿ��ʱ��仯��ͼ��ʾ��8 min�ڷ���NH3��ƽ����������Ϊ mol��L-1��min-1��
2NH3 ��H<0���������¶Ȳ��䣬ij��ȤС��ͬѧ��÷�Ӧ������������ѹǿ��ʱ��仯��ͼ��ʾ��8 min�ڷ���NH3��ƽ����������Ϊ mol��L-1��min-1��
 H=-akJ��mol-1
H=-akJ��mol-1



 2SO3(g) ��H=��198kJ��mol-1
2SO3(g) ��H=��198kJ��mol-1