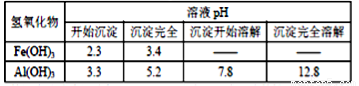
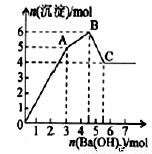
题目内容
一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2(g)+O2(g) 2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是

A.甲中反应的平衡常数小于乙B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率:a1>a2=a3D.容器中S03的物质的量浓度:丙=丁<甲
练习册系列答案
相关题目
6.可以用浓硫酸干燥的气体是( )
| A. | NH3 | B. | H2O | C. | CO2 | D. | H2S |
5.下列各组物质形成的晶体中,晶体类型相同的是( )
| A. | 晶体硅和SiC | B. | C60和Mg | C. | NaCl和HCl | D. | SO2和SiO2 |
2.下列烃和H2加成反应可生成3-甲基己烷的是( )
| A. | CH2=CHCH(CH3)CH2CH2CH2CH3 | B. | CH2=CHC(CH3)=CHCH2CH3 | ||
| C. | CH2=CHCH(CH3)C≡CH | D. | CH3CH2CH2CH2C(CH3)=CH2 |
3.把1OOmL2mol/L的H2SO4跟过量锌粉反应.在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的( )
| A. | 醋酸钠溶液 | B. | 硫酸铜溶液 | C. | 硝酸钠溶液 | D. | 氢氧化钠溶液 |


 ,该化合物与BA3反应生成B的单质,写出该反应的化学反应方程式3HClO+2NH3=3HCl+N2+3H2O.
,该化合物与BA3反应生成B的单质,写出该反应的化学反应方程式3HClO+2NH3=3HCl+N2+3H2O.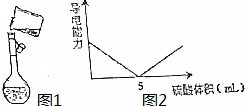 用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L稀硫酸的实验步骤如下:
用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L稀硫酸的实验步骤如下: