题目内容
9. 用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L稀硫酸的实验步骤如下:
用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L稀硫酸的实验步骤如下:①计算所用浓硫酸的体积;
②量取一定体积的浓硫酸;
③稀释;
④冷却,转移,洗涤,摇匀;
⑤定容,摇匀;
⑥转入试剂瓶,贴标签.
回答下列问题:
(1)所需浓硫酸的体积是8.2mL,量取浓硫酸所用量筒的规格是a(填编号,下同);选用的容量瓶的规格是e.
a.10mL b.50mL c.100mL d.200mL e.500mL f.1000mL
(2)第③步实验的操作步骤是稀释.
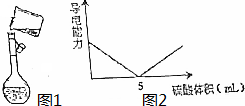
(3)如图1是某同学转移溶液的示意图,图中的错误是没有用玻璃棒引流.
(4)下列操作可能使所配溶液的物质的量浓度偏高的是e(填编号,下同),对配制结果没有影响的是a.
a.选用的容量瓶内有少量的蒸馏水
b.往容量瓶转移溶液时,有少量液体溅出
c.未洗涤稀释浓H2SO4的小烧杯
d.所用的浓硫酸长时间放置在密封不好的容器中
e.用量筒量取浓硫酸时,仰视读数
(5)将此溶液逐滴加入20mL Ba(OH)2溶液中,溶液的导电性变化如图2所示,则此氢氧化钡溶液的浓度为0.075mol/L.
分析 (1)求出浓硫酸的物质的量浓度C=$\frac{1000ρω}{M}$,然后根据稀释定律C浓V浓=C稀V稀来分析;然后根据所需的浓硫酸的体积来选取量筒的规格;容量瓶只有一条刻度线,只能配制出与其规格相对应的体积的溶液;
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序,来分析第③步实验的操作步骤;
(3)为防止溶液溅出,在移液时应用玻璃棒引流;
(4)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(5)当加入的硫酸能将Ba(OH)2恰好完全中和时,溶液的导电性最差,据此分析.
解答 解:(1)浓硫酸的物质的量浓度C=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要的浓硫酸的体积为VmL,根据稀释定律C浓V浓=C稀V稀可知:18.4mol/L×VmL=0.3mol/L×500mL,解得V=8.2mL;
选择量筒时,应根据大而近的原则来选择,根据所需的浓硫酸的体积可知应选取量筒的规格为10mL,故选a;
容量瓶只有一条刻度线,只能配制出与其规格相对应的体积的溶液,故配制500ml溶液应选择500mL容量瓶,故选e.
故答案为:8.2;a;e;
(2)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序可知,第③步实验操作为稀释,故答案为:稀释;
(3)为防止溶液溅出,在移液时应用玻璃棒引流,故答案为:没有用玻璃棒引流;
(4)a.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响;
b.往容量瓶转移溶液时,有少量液体溅出,会导致溶质的损失,则浓度偏低;
c.未洗涤稀释浓H2SO4的小烧杯,会导致溶质的损失,则浓度偏低;
d.所用的浓硫酸长时间放置在密封不好的容器中,会导致浓硫酸吸水,浓度偏低,则所量取的浓硫酸中硫酸溶质的量会偏小,导致所配溶液的浓度偏低;
e.用量筒量取浓硫酸时,仰视读数,则所量取的浓硫酸的体积偏大,则所配稀硫酸的浓度偏高.
故答案为:e;a;
(5)当加入的硫酸能将Ba(OH)2恰好完全中和时,溶液的导电性最差,而此时加入的硫酸的体积为5mL,设Ba(OH)2溶液的浓度为Xmol/L,根据反应可知:
Ba(OH)2 +H2SO4 =BaSO4 +2H2O
1 1
20mL×Xmol/L 0.3mol/L×5mL
可知:$\frac{1}{20X}=\frac{1}{0.3×5}$
解得:X=0.075mol/L,
故答案为:0.075.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案| A. | 28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA | |
| B. | l mol Fe(NO3)3与足量HI溶液反应时转移的电子数为3NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 在标准状况下,11.2L NO2所含电子数为11.5NA |
| A. |  | B. |  | C. |  | D. |  |
| A. | 0.1mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1 NaHS溶液中:c(H2S)+c(H+)=c(OH-)+c(S2-) | |
| C. | 将pH=2的盐酸和pH=12的氨水等体积混合后的溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1 NH4HSO4溶液与0.1 mol•L-1 NaOH溶液等体积混合后的溶液中:c(Na+)>c(NH4+)>c(SO42-) |
 ) 发生酯化反应的产物.
) 发生酯化反应的产物. 、
、 、
、 任意一种.
任意一种. ,R-ONa$→_{△}^{Cl-R′}$R-O-R′(R-、R′-表烃基)
,R-ONa$→_{△}^{Cl-R′}$R-O-R′(R-、R′-表烃基)
 .
.
 .
. (任写一种).
(任写一种). 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
 2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
 :1,2-二甲苯.
:1,2-二甲苯. CH3COONH4+H2O+2Ag↓+3NH3.
CH3COONH4+H2O+2Ag↓+3NH3. )与2mol乙醇发生酯化反应的化学方程式:
)与2mol乙醇发生酯化反应的化学方程式: .
. ,可能发生的化学反应除加成反应外,还有取代反应(填一种反应类型).
,可能发生的化学反应除加成反应外,还有取代反应(填一种反应类型).