题目内容
16.已知:H2(g)+F2(g)═2HF(g)△H=-546.6kJ•mol-1,下列说法中不正确的是( )| A. | 1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量大于546.6 kJ | |
| B. | 44.8L氟化氢气体分解成22.4L的氢气和22.4L的氟气吸收546.6 kJ热量 | |
| C. | 相同条件下,1mol氢气与1mol氟气的能量总和高于2mol氟化氢气体的能量 | |
| D. | 2molH-F键的键能比1molH-H键和1mol F-F键的键能之和大546.6kJ |
分析 A、液态氟化氢的能量比气态氟化氢的能量低,根据反应热与能量关系判断;
B、热化学方程式的正逆两个过程的焓变符号相反,数值相等;
C、反应物总能量大于生成物的总能量为放热反应,反应物总能量小于生成物的总能量为吸热反应;
D、根据化学反应的焓变和键能之间的关系来回答.
解答 解:A、液态氟化氢的能量比气态氟化氢的能量低,根据能量守恒,1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量大于546.6 kJ,故A正确;
B、由热化学方程式可知44.8L即2mol氟化氢气体分解成22.4L极1mol的氢气和22.4L即1mol的氟气吸收546.6 kJ热量,化学计量数表示物质的量,不是体积,故B错误;
C、反应为放热反应,在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量,故C正确;
D、旧键的断裂吸收能量,新键的生成释放能量,该反应是放热反应,所以2molH-F键的键能比1molH-H键和1molF-F键的键能之和大546.6kJ,故D正确.
故选B.
点评 本题考查学生对热化学方程式的理解、反应热与能量关系,难度不大,注意反应物总能量大于生成物的总能量为放热反应,反应物总能量小于生成物的总能量为吸热反应.

练习册系列答案
相关题目
7.中科院国家纳米科学中心2013年11月22日宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据.这不仅将人类对微观世界的认识向前推进了一大步,也为在分子、原子尺度上的研究提供了更精确的方法.下列说法中正确的是( )
| A. | 氢键是自然界中最重要、存在最广泛的化学键之一 | |
| B. | 正是氢键的存在,冰能浮在水面上 | |
| C. | 由于氢键的存在,沸点:HCl>HBr>HI>HF | |
| D. | 由于氢键的存在,水分子变的更稳定了 |
4.下列各组元素最高价氧化物对应水化物碱性渐弱,酸性渐强的是( )
| A. | NaOH、Mg(OH)2、H3PO4、H2SO4 | B. | NaOH、KOH、H2SO4、HClO4 | ||
| C. | Be(OH)2、Ca(OH)2、HBrO4、HClO4 | D. | Mg(OH)2、Ba(OH)2、H3PO4、H2SO4 |
11.自来水可用氯气消毒,用这种自来水配制下列物质溶液,不会产生明显的药品变质问题的是( )
| A. | AgNO3溶液 | B. | NaCl | C. | FeCl2 | D. | NaOH |
8.在下列无色透明溶液中,能大量共存的离子组是( )
| A. | Cu2+、Na+、SO42-、Cl- | B. | Ca2+、NH4+、Cl-、OH- | ||
| C. | Ba2+、H+、I-、SO42- | D. | Mg2+、Na+、NH4+、NO3- |
5.当萘与H2以物质的量比为1:1发生加成反应时,与1,3-丁二烯发生1,4-加成相似的产物有( )
①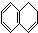 ②
② ③
③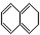 ④
④
①
 ②
② ③
③ ④
④
| A. | ①③ | B. | ②④ | C. | ②③ | D. | ①④ |
6.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 4.6gNO2和N2O4的混合气体中氧原子数小于0.2NA | |
| B. | 1 L 0.1 mol.L-1的Na2S溶液中离子总数小于0.3NA | |
| C. | 在标况下,2.24 L CCl4含有0.4NA个Cl原子 | |
| D. | 0.1 mol H2O2参加氧化还原反应时,不一定转移0.2NA个电子 |