题目内容
20. 现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:
现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:(1)B元素在元素周期表中的位置是第三周期IIIA族
(2)A、B、C三种元素最高价氧化物对应的水化物酸性渐强、碱性渐弱的顺序是(写化学式)NaOH、Al(OH)3、H2SO4
(3)A、B两元素的最高价氧化物对应的水化物之间可以发生反应,其离子方程式为Al(OH)3+OH-=AlO2-+2H2O
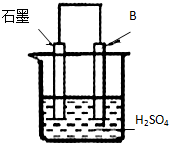
(4)将B单质与石墨按右图装置连接,石墨电极的名称为正极;另一电极反应式为:Al-3e-=Al3+.
分析 令B的相对原子质量为Mr,化合价为x,根据电子转移得:$\frac{0.9}{Mr}$×x=$\frac{1.12}{22.4}$×2,即Mr=9x,B为短周期金属,x=1,Mr=9,不符合题意;x=2,Mr=18,不符合题意;x=3,Mr=27,符合题意,故B为Al元素;若A、C不在同周期,C的原子序数大于13,故C处于第三周期、A处于第二周期,没有元素同时满足质子数之和为27,最外层电子数之差为5,若A、C在同周期,则C+A=27,C-A=5,可得C=16,A=11,即A为钠、B为硫,据此解答.
解答 解:令B的相对原子质量为Mr,化合价为x,根据电子转移得:$\frac{0.9}{Mr}$×x=$\frac{1.12}{22.4}$×2,即Mr=9x,B为短周期金属,x=1,Mr=9,不符合题意;x=2,Mr=18,不符合题意;x=3,Mr=27,符合题意,故B为Al元素;若A、C不在同周期,C的原子序数大于13,故C处于第三周期、A处于第二周期,没有元素同时满足质子数之和为27,最外层电子数之差为5,若A、C在同周期,则C+A=27,C-A=5,可得C=16,A=11,即A为钠、B为硫,
(1)由上述分析可知,B为Al,Al元素在元素周期表中的位置是第三周期IIIA族,
故答案为:第三周期IIIA族;
(2)NaOH属于强碱,Al(OH)3属于两性氢氧化物,H2SO4 是强酸,故酸性渐强、碱性渐弱的顺序;NaOH、Al(OH)3、H2SO4 ,
故答案为:NaOH、Al(OH)3、H2SO4 ;
(3)氢氧化钠可与氢氧化铝反应,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)原电池本质是Al与硫酸反应生成硫酸铝与氢气,Al发生氧化反应,做负极,故石墨为正极,氢离子在正极放电生成氢气,另一电极为负极,铝在负极失去电子,电极反应式:Al-3e-=Al3+,
故答案为:正极;Al-3e-=Al3+.
点评 本题考查原子结构与元素周期表的关系,推断元素是解题的关键,注意整体把握元素周期表的结构,难度中等.

 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案(1)2H2(气)+O2(气)═2H2O(气)+Q1
(2)2H2(气)+O2(气)═2H2O(液)+Q2
(3)H2(气)+O2(气)═H2O(气)+Q3.
| A. | Q1>Q2,Q2=2Q3 | B. | Q1=Q2=Q3 | C. | Q1<Q2,Q3=$\frac{{Q}_{1}}{2}$ | D. | 无法比较 |
①除去乙烷中少量的乙烯:通入酸性高锰酸钾溶液,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
 铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是( )
铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是( )| A. | 复分解反应、复分解反应、化合反应、置换反应 | |
| B. | 中和反应、置换反应、复分解反应、置换反应 | |
| C. | 复分解反应、复分解反应、置换反应、置换反应 | |
| D. | 分解反应、复分解反应、置换反应、置换反应 |
| A. | N | B. | M | C. | Q | D. | K |
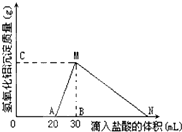 在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示.问:
在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示.问:
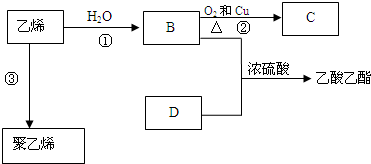
 .
. 反应类型:加聚反应
反应类型:加聚反应