题目内容
6.下列关于化学反应限度的说法中不正确的是( )| A. | 当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度 | |
| B. | 当一个可逆反应进行到平衡状态时,那么这个反应的正逆反应速率相等 | |
| C. | 平衡状态是一种静止的状态,因此反应物和生成物的浓度已经不再改变 | |
| D. | 化学反应的限度可以通过改变条件而改变 |
分析 A.当一个可逆反应达到平衡状态时,正逆反应速率相等,这个反应在该条件下反应物的转化率最大;
B.当一个可逆反应进行到平衡状态时,那么这个反应的正逆反应速率相等但不等于0;
C.平衡状态是一种动态平衡,反应物和生成物的浓度不再改变;
D.反应条件改变,平衡可能被破坏,所以反应限度被破坏.
解答 解:A.当一个可逆反应达到平衡状态时,正逆反应速率相等,这个反应在该条件下反应物的转化率最大,所以就是这个反应在该条件下所能达到的限度,故A正确;
B.当一个可逆反应进行到平衡状态时,那么这个反应的正逆反应速率相等但不等于0,反应达到动态平衡状态,故B错误;
C.平衡状态是一种动态平衡,正逆反应速率相等,所以反应物和生成物的浓度不再改变,故C正确;
D.反应条件改变,平衡可能被破坏,则反应限度被破坏,直到达到新的平衡状态,故D正确;
故选B.
点评 本题考查化学平衡状态,化学反应达到平衡状态时正逆反应速率相等但不是0,且化学平衡状态受反应条件的影响,题目难度不大.

练习册系列答案
相关题目
16. 据媒体报道,一些非法油厂用大豆油、棕榈油、粗制棉油等添加香精勾兑成花生油.如图就是一种香精的结构,下列对该香精的叙述不正确的是( )
据媒体报道,一些非法油厂用大豆油、棕榈油、粗制棉油等添加香精勾兑成花生油.如图就是一种香精的结构,下列对该香精的叙述不正确的是( )
 据媒体报道,一些非法油厂用大豆油、棕榈油、粗制棉油等添加香精勾兑成花生油.如图就是一种香精的结构,下列对该香精的叙述不正确的是( )
据媒体报道,一些非法油厂用大豆油、棕榈油、粗制棉油等添加香精勾兑成花生油.如图就是一种香精的结构,下列对该香精的叙述不正确的是( )| A. | 该香精能够水解,其水解产物中有醇 | |
| B. | 该香精能够使酸性KMnO4溶液褪色 | |
| C. | 该香精能够与溴水发生加成反应 | |
| D. | 1 mol该香精中含有1 mol碳氧双键和4 mol碳碳双键 |
17.在密闭容器中进行反应2SO2+O2?2SO3,SO2、O2、SO3的起始浓度分别为0.2mol•L-1,0.1mol•L-1,0,2mol•L-1,当平衡时,下列数据正确的是( )
| A. | SO2的浓度为0.25 mol•L-1,SO3的浓度为0.25mol•L-1 | |
| B. | SO3的浓度为0.3mol•L-1 | |
| C. | SO2的浓度为0.4 mol•L-1,O2的浓度为0.2 mol•L-1 | |
| D. | SO3的浓度为0.4 mol•L-1 |
14.科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )


| A. | a为正极,b为负极 | |
| B. | 生产过程中a电极质量减轻 | |
| C. | 电子从b极向a极移动 | |
| D. | 负极反应式为:SO2+2H2O-2e-=SO42-+4H+ |
1.某无色溶液中可能含有H+、OH-、K+、NO3-,加入铝粉后,只产生H2.试回答:
(1)加入铝粉产生H2,说明铝具有还原性(填“氧化性”或“还原性”).
(2)甲同学分析:若H+大量存在,则NO3-就不能大量存在.设计实验证实如表:
①盐酸溶解Al2O3薄膜的离子方程式是6H++Al2O3═2Al3++3H2O.
②根据现象Ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
a.浅棕色气体是NO2.
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能.
c.实验1、2说明反应生成了NO,写出该反应的离子方程式:Al+NO3?+4H+═Al3++NO↑+2H2O.
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.重新设计实验证实如表:
为确认“刺激性气味”气体,进行如下实验:用湿润KI-淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝. 则:
①刺激性气味的气体是NH3.
②产生该气体的离子方程式是8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-.
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成.实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.因此无色溶液一定能大量存在的是K+、OH-.
(1)加入铝粉产生H2,说明铝具有还原性(填“氧化性”或“还原性”).
(2)甲同学分析:若H+大量存在,则NO3-就不能大量存在.设计实验证实如表:
| 装 置 | 现 象 |
 | Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 Ⅲ.试管变热,溶液沸腾 |
②根据现象Ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能.
c.实验1、2说明反应生成了NO,写出该反应的离子方程式:Al+NO3?+4H+═Al3++NO↑+2H2O.
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.重新设计实验证实如表:
| 装置 | 现象 |
 | Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,有刺激性气味 |
①刺激性气味的气体是NH3.
②产生该气体的离子方程式是8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-.
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成.实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.因此无色溶液一定能大量存在的是K+、OH-.
18.下列反应属于加成反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 2C6H6+15O2$\stackrel{点燃}{→}$12CO2+6H2O |
16.下列说法正确的是( )
| A. | 已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,则PM为2.5的大气一定能产生丁达尔现象 | |
| B. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| C. | ${\;}_{1}^{2}$H、${\;}_{1}^{3}$H是制造氢弹的原料,它们是同一种核素 | |
| D. | 太阳能电池可采用硅材料制作,其应用有利于环保、节能 |
 E的电子式为
E的电子式为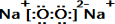 ;
;