题目内容
6.氮元素的单质及化合物在工农业生产中有重要应用.(1)①氮气用于工业合成氨,写出氮气的电子式
 ;②NH3的稳定性比PH3强(填写“强”或“弱”).
;②NH3的稳定性比PH3强(填写“强”或“弱”).(2)如图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象.
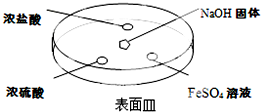
①浓盐酸液滴附近发生反应的化学方程式为NH3+HCl═NH4Cl.
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是NH4HSO4或(NH4)2SO4(写化学式,一种即可).
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3•H2O═Fe(OH)2↓+2NH4+和4Fe(OH)2+O2+2H2O═4Fe(OH)3.
(3)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+
(4)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物.首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙.
已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3
写出氧化吸收法除去氮氧化物的化学方程式3O2+2NO+6NO2+4Ca(OH)2=4Ca(NO3)2+4H2O
(5)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为2NH3+3O2$\frac{\underline{\;微生物\;}}{\;}$2HNO2+2H2O,若反应中有3mol电子发生转移时,生成亚硝酸的质量为2.35g.
分析 (1)①氮气中N原子满足最外层8电子稳定结构,存在N≡N;
②非金属性越强,气态氢化物越稳定;
(2)①浓盐酸液滴附近会出现白烟,发生HCl与氨气的反应生成氯化铵;
②浓硫酸难挥发,能与氨气反应生成硫酸盐;
③FeSO4与碱反应生成白色沉淀,然后出现灰绿色沉淀,过一段时间后变成红褐色,氢氧化亚铁被氧化;
(3)二氧化硫和氯化钡不反应,氨气和二氧化硫、水反应生成亚硫酸铵,亚硫酸铵和氯化钡发生复分解反应;二氧化硫能被硝酸氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;
(4)NO、二氧化氮和氧气、氢氧化钙反应生成硝酸钙和水;
(5)氨能够被氧气氧化生成亚硝酸(HNO2),由质量守恒定律可知还生成水;结合元素的化合价变化计算.
解答 解:(1)①氮气中N原子满足最外层8电子稳定结构,存在N≡N,则氮气的电子式为 ,故答案为:
,故答案为: ;
;
②非金属性N>P,则NH3的稳定性比PH3强,故答案为:强;
(2)①浓盐酸液滴附近会出现白烟,发生HCl与氨气的反应生成氯化铵,该反应为NH3+HCl═NH4Cl,故答案为:NH3+HCl═NH4Cl;
②浓硫酸难挥发,能与氨气反应生成硫酸盐,则一段时间后浓硫酸的液滴中生成的白色固体为NH4HSO4或(NH4)2SO4,故答案为:NH4HSO4或(NH4)2SO4;
③FeSO4与碱反应生成白色沉淀,发生反应为Fe2++2NH3•H2O═Fe(OH)2↓+2NH4+,然后出现灰绿色沉淀,过一段时间后变成红褐色,是因氢氧化亚铁被氧化,发生反应为4Fe(OH)2+O2+2H2O═4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(3)二氧化硫和氯化钡不反应,氨气和二氧化硫、水反应生成亚硫酸铵,亚硫酸铵和氯化钡发生复分解反应,反应方程式为2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+;二氧化硫能被硝酸氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀,反应方程式为3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+,
故答案为:2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+;3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+;
(4)NO、二氧化氮和氧气、氢氧化钙反应生成硝酸钙和水,反应方程式为3O2+2NO+6NO2+4Ca(OH)2=4Ca(NO3)2+4H2O,
故答案为:3O2+2NO+6NO2+4Ca(OH)2=4Ca(NO3)2+4H2O;
(5)氨能够被氧气氧化生成亚硝酸(HNO2),由质量守恒定律可知还生成水,该反应为2NH3+3O2$\frac{\underline{\;微生物\;}}{\;}$2HNO2+2H2O,由反应可知,生成2molHNO2时转移2mol×[3-(-3)]=12mol电子,则有0.3mol电子发生转移时,生成亚硝酸0.3mol×$\frac{2}{12}$=0.05mol,其质量为0.05mol×47g/mol=2.35 g,
故答案为:2NH3+3O2$\frac{\underline{\;微生物\;}}{\;}$2HNO2+2H2O;2.35.
点评 本题以氨气的性质考查物质之间的反应,涉及氧化还原反应、离子方程式和化学方程式书写、物质结构等,综合性较强,侧重学生分析能力和计算能力的考查,注意知识的迁移应用,题目难度中等.

| A. | O2 | B. | CO | C. | CO2 | D. | H2 |
| A. | 5.6g铁与足量氯气完全反应时失去的电子数目为0.2NA | |
| B. | 标准状况下,11.2L H2中含有的电子数为1NA | |
| C. | 标准状况下,2.24 L水中含有水分子0.1 NA | |
| D. | 2L1mol/L的盐酸中所含氯化氢分子数为2NA |
| A. | 向NaOH溶液中通入少量的SO2:SO2+OH-═HSO3- | |
| B. | 向氯水中通入少量的SO2:Cl2+SO2+2H2O═4H++2Cl-+SO42- | |
| C. | 将SO2通入到饱和的NaHCO3溶液中:2H++CO32-═H2O+CO2↑ | |
| D. | 将SO2通入到BaCl2溶液中:SO2+H2O+Ba2+═BaSO3↓+2H+ |
| A. | 活泼金属跟酸反应 | B. | 煤气燃烧 | ||
| C. | 酸碱中和反应 | D. | 工业制生石灰 |
 .
.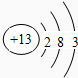 ;
;