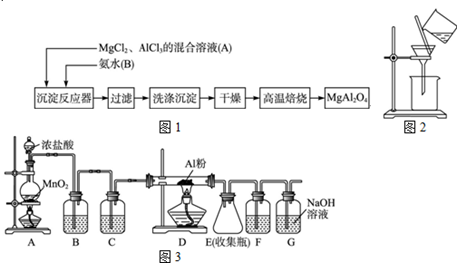
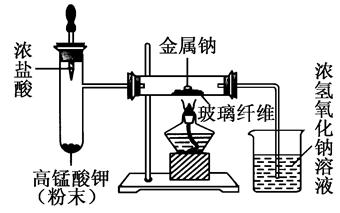
题目内容
在实验室测定碳酸钠与碳酸氢钠的混合物中,碳酸钠的质量分数[用符号w(Na2CO3)表示],称取此混合物5.lg,溶于水中,配成250mL溶液。
a.(10分)方案一:沉淀法测w(Na2CO3)利用化学反应把HCO3-、CO32-完全转化为沉淀,称取沉淀的质量,由此计算混合物中w (Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选的试剂是___________ (填编号)。
| A.CaCl2 | B.MgSO4 | C..NaCI | D.Ba(OH)2 |
(3)过滤,提取沉淀,则过滤操作所需要的玻璃仪器有________________________。
(4)洗涤沉淀,简述洗涤沉淀的操作_____________________________。
(5)干燥充分,称取沉淀的质量为9.8g,由此计算w(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得w (Na2CO3)________________(填偏大或偏小、无影响)。
b.方案二:滴定法测w(Na2CO3)量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L的盐酸进行滴定到终点。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。 [已知饱和的碳酸溶液PH为3.9]
(1)量取25.00 mL配制好的溶液,应选择_______________仪器来完成。
(2)判断滴定终点的依据是_____________________,此过程中反应的离子方程式为__________________________________________________。
(3)此法测得w(Na2CO3)=________%(保留两位小数)
a(1)D
(2)静止,澄清,然后向上层清液中滴加Ba(0H)2溶液,若有沉淀产生,说明未沉淀完全,反之,则沉淀完全
(3) 烧杯、普通漏斗、玻璃棒
(4) 向漏斗的沉淀上加蒸馏水使其没过沉淀,过滤,重复操作2到3次
(5) 偏小
b(1)碱式滴定管
(2)溶液由红色变为无色,且半分钟内不变色 H++CO32-=HCO3-
(3)83.14
解析试题分析:a(1)A、CaCl2不与HCO3-反应,错误;B、MgSO4不与HCO3-反应,错误;C、NaCI均不反应,错误;D 、Ba(0H)2均反应生成沉淀,正确,答案选D。
(2)溶液中若存在HCO3-、CO32-,则继续滴加Ba(0H)2溶液会有沉淀产生,所以证明HCO3-、CO32-已完全沉淀的实验操作是:静止,澄清,然后向上层清液中滴加Ba(0H)2溶液,若有沉淀产生,说明未沉淀完全,反之,则沉淀完全
(3)过滤操作所需要的玻璃仪器有:烧杯、普通漏斗、玻璃棒
(4)洗涤沉淀的操作是:向漏斗的沉淀上加蒸馏水使其没过沉淀,过滤,重复操作2到3次
(5)沉淀未干燥会导致沉淀的质量增大,从而计算出的碳酸钠的质量减小,所以测得w (Na2CO3)偏小
b((1)(3)每空2分,(2)每空1分)
(1)碳酸钠与碳酸氢钠的溶液显碱性,应用碱式滴定管量取
(2)碳酸钠与碳酸氢钠的溶液显碱性,使酚酞试液变红,所以滴定终点时溶液由红色变为无色,且半分钟内不变色;方案b中用酚酞作指示剂,所以滴定终点时的溶液仍为碱性,即盐酸滴定碳酸钠和碳酸氢钠的混合液时,盐酸与碳酸钠反应生成碳酸氢钠,不产生二氧化碳气体,所以此过程发生的离子方程式为H++CO32-=HCO3-
(3)由(2)知H+~CO32-因此由消耗盐酸的体积可计算出碳酸钠的物质的量n(Na2CO3)=0.2mol/L×20×10-3L=0.004mol,所以原溶液中碳酸钠的质量为
0.004mol×10×106g/mol=4.24g,则w(Na2CO3)=4.24g/5.1g×100%=83.14%
考点:考查试剂的选择,沉淀完全的判断,洗涤操作,误差分析,仪器的选择,质量分数的计算

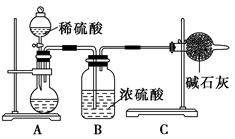
(16分)某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).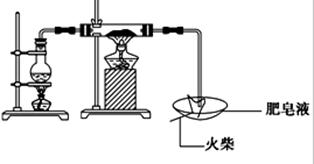
(1)如何检查该装置的气密性:
(2)写出铁与水蒸气反应的化学方程式
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水。
在答题卡上按下表的格式写出实验步骤、预期现象与结论。
| | 实验步骤 | 预期现象与结论 |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的 ,振荡溶解,过滤后将滤液配成250mL溶液,待用。 | |
| 步骤2 | 取少量步骤1中滤液于试管中, | |
| 步骤3 | 取少量步骤1中滤液于试管中, | |
(4)固体产物中铁元素的质量分数的测定可采用下图的流程
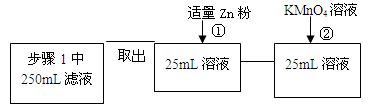
其中步骤①是向溶液中加入锌粉至黄色刚好消失;步骤②用0.010 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液平均为v mL。(已知5Fe2++MnO4- +8H+==5Fe3++Mn2++4H2O)
其中加入锌粉的目的是____ ____。
实验测得ag样品中固体产物铁元素的质量分数为____ __ _(只列计算表达式)。
草酸亚铁晶体(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。回答下列问题:
I.兴趣小组对草酸亚铁晶体的分解产物进行实验和探究。探究分解得到的固体产物中铁元素的存在形式。
(1)提出假设
假设一:___________; 假设二:全部是FeO ; 假设三:FeO和Fe混合物。
(2)设计实验方案证明假设三。
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分震荡 | 若溶液颜色明显改编,且有 生成,则证明有铁单质存在 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:去步骤2得到少量固体与试管中,滴加 | |
限选试剂:稀盐酸、新制的氯水、0.1mol.L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
Ⅱ.兴趣小组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为:_______________
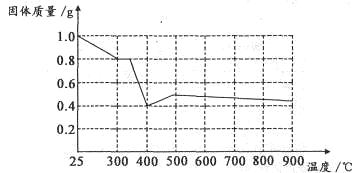
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g。某同学由此得出结论:假设二不成立。你是否同意该同学的结论,并简述理由:______________________。