题目内容
12.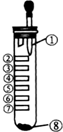 氯气性质的微型实验装置如图所示,①是浓盐酸,⑧是高锰酸钾,②至⑦是滤纸条,依次滴有品 红溶液、石蕊试液、淀粉KI试液、Na2S 溶液、KBr 溶液、含KSCN 的FeCl2几种溶液,实验时挤几滴浓盐酸,下列说法错误的是( )
氯气性质的微型实验装置如图所示,①是浓盐酸,⑧是高锰酸钾,②至⑦是滤纸条,依次滴有品 红溶液、石蕊试液、淀粉KI试液、Na2S 溶液、KBr 溶液、含KSCN 的FeCl2几种溶液,实验时挤几滴浓盐酸,下列说法错误的是( )| A. | 产生氯气的离子方程式:16H++10Cl-+2MnO${\;}_{4}^{-}$=2Mn2++5Cl2↑+8H2O | |
| B. | ⑦处变血红色,是因为2Fe2++Cl2=2Fe3++2Cl-,Fe3++3SCN-=Fe(SCN)3 | |
| C. | ②褪色,③处先变红后褪色,⑤处出现淡黄色固体 | |
| D. | ④处变蓝,⑥处变橙红,能说明氧化性:Cl2>Br2>I2 |
分析 A、高锰酸钾溶液和浓盐酸反应生成氯气;
B、氯气氧化氯化亚铁为氯化铁,铁离子遇到硫氰酸钾溶液显红色;
C、氯气具有漂白性可以使品红褪色,遇到石蕊试液先变红色后褪色;
D、氯气和碘化钾反应生成碘单质,碘单质遇到淀粉变蓝色,氯气和溴化钾反应生成溴单质,溶液呈橙色,是溴单质溶于水的现象.
解答 解:A、高锰酸钾溶液和浓盐酸发生氧化还原反应生成氯气,反应的离子方程式为:16H++10Cl-+2MnO4-=2Mn2++5Cl2↑+8H2O,故A正确;
B、氯气氧化氯化亚铁为氯化铁,铁离子遇到硫氰酸钾溶液显红色,反应为:2Fe2++Cl2=2Fe3++2Cl-,Fe3++3SCN-=Fe(SCN)3,故B正确
C、氯气具有漂白性可以使品红褪色,氯气遇到水反应生成盐酸和次氯酸遇到石蕊试液先变红色后褪色,故C正确;
D、氯气和碘化钾反应生成碘单质,碘单质遇到淀粉变蓝色,氯气和溴化钾反应生成溴单质,溶液呈橙色,是溴单质溶于水的现象,上述反应说明氯气氧化性大于碘单质和溴单质,但不能证明溴单质氧化性大于碘单质,故D错误;
故选D.
点评 本题考查了氯气性质的分析应用,氯气氧化性、漂白性、制备方法和反应现象是解题关键,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列叙述正确的是( )
| A. | 由同种元素组成的物质肯定是纯净物 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 含有金属元素的离子一定都是阳离子 | |
| D. | 两种原子若核外电子排布相同,则一定属于同种元素 |
7.用水稀释0.1mol/L的醋酸溶液,其中随加水量的增加而增大的有( )
| A. | C(CH3COOH) | B. | C(H+) | C. | C(H+)/C(CH3COOH) | D. | C(CH3COOH)/C(H+) |
17.下列离子组在给定条件下,离子共存判断及反应的离子方程式均正确的是( )
| 选项 | 条 件 | 离子组 | 离子共存判断及离子方程式 |
| A | 常温下,由水电离出的C(H+)为1×10-12 mol•L-1 | K+、Cl-、S2-SO32- | 一定能大量共存 |
| B | 滴加氨水 | Na+、Fe3+、Cl- | 不能大量共存 Fe3++3OH-═Fe(OH)3↓ |
| C | p=1的溶液 | Fe3+、I- Cl- | 不能大量共存 2Fe3++2I-═2Fe2++I2 |
| D | 通入少量SO2气体 | K+、Na+、ClO- | 不能大量共存 2ClO-+SO2+H2O═2HClO+SO32- |
| A. | A | B. | B | C. | C | D. | D |
4.下列叙述正确的是( )
| A. | 当某可逆反应平衡向正反应方向移动时,反应物的转化率一定增加 | |
| B. | 已知金刚石不如石墨稳定,则石墨转变为金刚石需要放热 | |
| C. | 盐酸与某强碱中和放出的热量随反应物的用量改变而改变,但中和热不变 | |
| D. | S(s)+O2(g)═SO2(g)△H3S(g)+O2(g)═SO2(g)△H4△H3<△H4 |
1.下列叙述错误的是( )
| A. | 将10gNaCl晶体溶入90g水中,制得10%的NaCl溶液 | |
| B. | 将40gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为1mol/L | |
| C. | 将wga%的NaCl溶液蒸发掉$\frac{w}{2}$g水,得到2a%的NaCl溶液 | |
| D. | 将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2 c1mol/L |
 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示.(说明:a中盛放稀硫酸;b中盛放Na2SO3固体)回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示.(说明:a中盛放稀硫酸;b中盛放Na2SO3固体)回答下列问题: 在一密闭容器中发生下列反应:2SO2(g)+O2(g)?2SO3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系.回答下列问题:
在一密闭容器中发生下列反应:2SO2(g)+O2(g)?2SO3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系.回答下列问题: