题目内容
1.下列叙述错误的是( )| A. | 将10gNaCl晶体溶入90g水中,制得10%的NaCl溶液 | |
| B. | 将40gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为1mol/L | |
| C. | 将wga%的NaCl溶液蒸发掉$\frac{w}{2}$g水,得到2a%的NaCl溶液 | |
| D. | 将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2 c1mol/L |
分析 A、根据质量分数=$\frac{溶质}{水+溶质}$计算;
B、溶液的体积不是水的体积;
C、若是饱和的溶液,蒸发水后,质量分数不变,若是不饱和溶液,且2a%最多为饱和溶液;
D、溶液稀释前后溶质的物质的量不变.
解答 解:A、将10gNaCl晶体溶入90g水中,NaCl溶液质量分数=$\frac{溶质}{水+溶质}$=10%,故A正确;
B、将40gNaOH溶于1L水中,溶液的体积不是水的体积,溶液的体积不知道,所以无法计算物质的量浓度,故B错误;
C、若是饱和的溶液,蒸发水后,质量分数不变;若是不饱和溶液,而且蒸发时没有固体析出,则得到2a%的NaCl溶液,故C错误;
D、溶液稀释前后溶质的物质的量不变,所以稀溶液物质的量浓度=$\frac{{c}_{1}mol/L×1}{5}$=0.2c1mol/L,故D正确.
故选BC.
点评 本题考查物质的量浓度、质量分数的有关计算,侧重考查分析计算能力,注意c=$\frac{n}{V}$中V指溶液体积而不是溶剂体积,题目难度不大.

练习册系列答案
相关题目
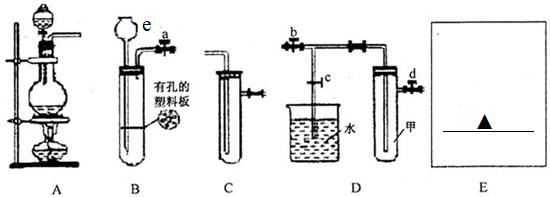
12.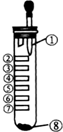 氯气性质的微型实验装置如图所示,①是浓盐酸,⑧是高锰酸钾,②至⑦是滤纸条,依次滴有品 红溶液、石蕊试液、淀粉KI试液、Na2S 溶液、KBr 溶液、含KSCN 的FeCl2几种溶液,实验时挤几滴浓盐酸,下列说法错误的是( )
氯气性质的微型实验装置如图所示,①是浓盐酸,⑧是高锰酸钾,②至⑦是滤纸条,依次滴有品 红溶液、石蕊试液、淀粉KI试液、Na2S 溶液、KBr 溶液、含KSCN 的FeCl2几种溶液,实验时挤几滴浓盐酸,下列说法错误的是( )
 氯气性质的微型实验装置如图所示,①是浓盐酸,⑧是高锰酸钾,②至⑦是滤纸条,依次滴有品 红溶液、石蕊试液、淀粉KI试液、Na2S 溶液、KBr 溶液、含KSCN 的FeCl2几种溶液,实验时挤几滴浓盐酸,下列说法错误的是( )
氯气性质的微型实验装置如图所示,①是浓盐酸,⑧是高锰酸钾,②至⑦是滤纸条,依次滴有品 红溶液、石蕊试液、淀粉KI试液、Na2S 溶液、KBr 溶液、含KSCN 的FeCl2几种溶液,实验时挤几滴浓盐酸,下列说法错误的是( )| A. | 产生氯气的离子方程式:16H++10Cl-+2MnO${\;}_{4}^{-}$=2Mn2++5Cl2↑+8H2O | |
| B. | ⑦处变血红色,是因为2Fe2++Cl2=2Fe3++2Cl-,Fe3++3SCN-=Fe(SCN)3 | |
| C. | ②褪色,③处先变红后褪色,⑤处出现淡黄色固体 | |
| D. | ④处变蓝,⑥处变橙红,能说明氧化性:Cl2>Br2>I2 |
9.下列说法中,正确的是( )
| A. | 有机物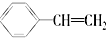 属于芳香烃,含有两种官能团 属于芳香烃,含有两种官能团 | |
| B. | 按系统命名法,化合物(CH3)2CHCH(CH3)CH2CH(CH3) CH(CH3)2的名称为2,3,5,6-四甲基庚烷 | |
| C. | 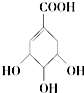 既属于酚类又属于羧酸类 既属于酚类又属于羧酸类 | |
| D. | 2甲基3丁烯的命名错误原因是选错了主链 |
16.胶体分散系与其它分散系的本质差别是( )
| A. | 分散质直径介于1~100nm之间 | B. | 是否有丁达尔效应 | ||
| C. | 是否稳定 | D. | 分散质粒子是否带电 |
6.0.5L AlCl3溶液中Cl-为9.03×1022个,则AlCl3溶液的物质的量浓度为( )
| A. | 0.1 mol•L-1 | B. | 1 mol•L-1 | C. | 3 mol•L-1 | D. | 1.5 mol•L-1 |
13.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则该反应的△H<0(填写“>”、“<”、“=”).
(2)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(3)某同学设计了三组实验,实验条件已经填在下面实验设计表中,分析表格我们可以看出该同学的实验目的主要是研究温度和催化剂比表面积对化学反应速率的影响.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)在上述条件下反应能够自发进行,则该反应的△H<0(填写“>”、“<”、“=”).
(2)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(3)某同学设计了三组实验,实验条件已经填在下面实验设计表中,分析表格我们可以看出该同学的实验目的主要是研究温度和催化剂比表面积对化学反应速率的影响.
| 实验编号 | T(℃) | NO初始浓(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
10.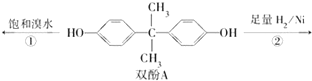 用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )
用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )
 用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )
用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )| A. | 双酚A的分子式是C15H16O2 | |
| B. | 反应①中,1 mol双酚A最多消耗2 mol Br2 | |
| C. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 | |
| D. | 反应②的产物中只有一种官能团 |
11.X22-离子共有2n个电子,元素X的原子核内的质子数为( )
| A. | n-1 | B. | n+1 | C. | n | D. | 2n |