题目内容
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。
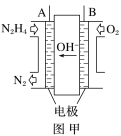
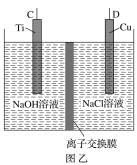
(1)上述装置中D电极应连接肼燃料电池的________极(填“A”或“B”),该电解池中离子交换膜为________离子交换膜(填“阴”或“阳”)。
(2)该电解池的阳极反应式为________________________________________,
肼燃料电池中A极发生的电极反应为____________________________。
(3)当反应生成14.4 g Cu2O时,至少需要肼________ mol。
【答案】B 阴 ![]()
![]() 0.05
0.05
【解析】
(1)燃料电池正极通氧化剂,负极通燃料,即A极为负极,B极为正极;图乙为电解池装置,电解目的为制备Cu2O,则D极作阳极接电池正极(B极),铜被氧化;阳极反应为2Cu-2e-+2OH- =Cu2O+H2O,反应消耗OH-,采用阴离子交换膜使OH-向阳极移动;
答案为B;阴;
(2)根据上述分析,阳极反应为2Cu-2e-+2OH- =Cu2O+H2O;肼燃料电池中A极肼(N2H4)失电子在碱性条件下生成氮气和水,发生的电极反应为N2H4-4e-+4OH- =N2+4H2O;
(3)根据电极反应2Cu-2e-+2OH- =Cu2O+H2O和N2H4-4e-+4OH- =N2+4 H2O可知,Cu2O与N2H4、e-的数量关系式为2Cu2O~ N2H4~4 e-,当反应生成14.4 g (0.1mol)Cu2O时,至少需要肼为0.05mol。

练习册系列答案
相关题目