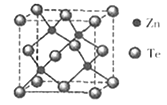
题目内容
【题目】A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化,其中A是单质。

(1)若C是淡黄色固体常用于呼吸面具中的供氧剂,D是一种强碱。则C作供氧剂时与CO2反应的化学方程式为_______________________;其中还原剂是________,氧化产物是___________,7.8g C参加反应时转移的电子数是___________。
(2)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此写出A元素的原子结构示意图是______。请写出A用于焊接铁轨的化学方程式___________________________。请写出②的离子方程式_____________________________。
【答案】 2Na2O2 + 2CO2 == 2Na2CO3 + O2 Na2O2 O2 0.1NA或6.02×1022 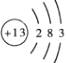 2Al + Fe2O3
2Al + Fe2O3![]() 2Al2O3 + Fe 2Al + 2OH- + 2H2O = 2AlO2- +3H2↑
2Al2O3 + Fe 2Al + 2OH- + 2H2O = 2AlO2- +3H2↑
【解析】(1)C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱,则C为Na2O2,D为NaOH;
(2)B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现,则A为Al,B为Al2O3,D为Al(OH)3;据此分析解答。
(1)C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱,则C为Na2O2,D为NaOH,过氧化钠和二氧化碳反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,Na2O2中O元素的化合价既升高,又降低,因此过氧化钠既是氧化剂,又是还原剂,元素化合价升高的失电子发生氧化反应,得到氧化产物,氧化产物为氧气,元素化合价降低得到电子发生还原反应得到还原产物,还原产物为碳酸钠;7.8g过氧化钠的物质的量为![]() =0.1mol,转移的电子为0.1mol,故答案为:2Na2O2 + 2CO2 == 2Na2CO3 + O2;Na2O2;O2;0.1NA或6.02×1022;
=0.1mol,转移的电子为0.1mol,故答案为:2Na2O2 + 2CO2 == 2Na2CO3 + O2;Na2O2;O2;0.1NA或6.02×1022;
(2)B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现,则A为Al,B为Al2O3,C为NaAlO2,D为Al(OH)3。铝为13号元素,原子结构示意图为 ,铝热反应可以用于焊接铁轨,反应的化学方程式为2Al + Fe2O3
,铝热反应可以用于焊接铁轨,反应的化学方程式为2Al + Fe2O3![]() 2Al2O3 + Fe,②的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:
2Al2O3 + Fe,②的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为: ;2Al + Fe2O3
;2Al + Fe2O3![]() 2Al2O3 + Fe;2Al+2OH-+2H2O=2AlO2-+3H2↑。
2Al2O3 + Fe;2Al+2OH-+2H2O=2AlO2-+3H2↑。

【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A<B<C<D。②四种元素之间形成的某三种分子的比例模型及部分性质如下:
物质 | 比例模型图 | 存在或性质 |
甲 |
| 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二 |
乙 |
| 无色,无气味并且易燃。是常见的一种基础能源 |
丙 |
| 有强氧化性的弱酸,有漂白性,可用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)A的元素符号是__________;C元素在元素周期表中的位置是_______;甲的电子式是_______。
(2)丙可由D元素的单质与物质甲反应得到,该反应的离子方程式是________;D所在周期中,E元素的单质还原性最强,则E的单质与甲反应后的溶液呈_______(填“酸”或“碱”)性,用电离方程式表示其原因是___________________________。
(3)①A、B、C元素可组成多种化合物。由A、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则实验室中可用来除去乙中少量丁的试剂是_________。
②A、B、C组成的化合物中,有2种化合物的化学式均为C2A6B,则这2种化合物的关系互称为_________。为了鉴别这两种化合物,某同学用一小块E的单质分别投入盛有这2种化合物的试管中,其中与E的单质发生反应的化学方程式是_______________。