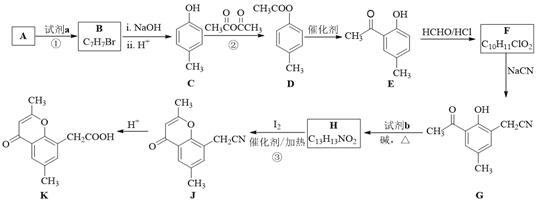
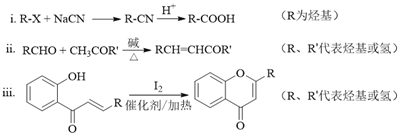题目内容
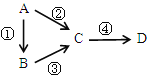
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A<B<C<D。②四种元素之间形成的某三种分子的比例模型及部分性质如下:
物质 | 比例模型图 | 存在或性质 |
甲 |
| 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二 |
乙 |
| 无色,无气味并且易燃。是常见的一种基础能源 |
丙 |
| 有强氧化性的弱酸,有漂白性,可用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)A的元素符号是__________;C元素在元素周期表中的位置是_______;甲的电子式是_______。
(2)丙可由D元素的单质与物质甲反应得到,该反应的离子方程式是________;D所在周期中,E元素的单质还原性最强,则E的单质与甲反应后的溶液呈_______(填“酸”或“碱”)性,用电离方程式表示其原因是___________________________。
(3)①A、B、C元素可组成多种化合物。由A、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则实验室中可用来除去乙中少量丁的试剂是_________。
②A、B、C组成的化合物中,有2种化合物的化学式均为C2A6B,则这2种化合物的关系互称为_________。为了鉴别这两种化合物,某同学用一小块E的单质分别投入盛有这2种化合物的试管中,其中与E的单质发生反应的化学方程式是_______________。
【答案】 H 第二周期第IVA族 ![]() Cl2+H2O=H++Cl-+HClO 碱 NaOH=Na++OH- ①Br2的CCl4溶液 同分异构体 2C2H5OH+2Na→2C2H5ONa+H2↑
Cl2+H2O=H++Cl-+HClO 碱 NaOH=Na++OH- ①Br2的CCl4溶液 同分异构体 2C2H5OH+2Na→2C2H5ONa+H2↑
【解析】四种短周期元素A、B、C、D,四种元素之间形成的某三种分子的比例模型及部分性质如下:甲:![]() 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二,则甲是H2O;乙:
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二,则甲是H2O;乙:![]() 无色,无气味并且易燃,是常见的一种基础能源,则乙是
无色,无气味并且易燃,是常见的一种基础能源,则乙是![]() ;丙:
;丙:![]() 有强氧化性的弱酸,可以用于消毒杀菌,则丙是HClO,因为原子半径A>B>C>D,所以A、B、C、D分别是Cl>C>O>H。
有强氧化性的弱酸,可以用于消毒杀菌,则丙是HClO,因为原子半径A>B>C>D,所以A、B、C、D分别是Cl>C>O>H。
(1)由上述分析知Cl>C>O>H。,所以A是H元素。主族元素原子核外电子层数等于其周期数,最外层电子数等于其族序数,C是C元素,其原子核外有2个电子层、最外层电子数是4,所以位于第二周期第IVA族;因为甲是H2O,所以甲的电子式是![]() 。
。
(2)因为丙可为HClO是由D元素的单质为Cl2与物质甲是H2O反应得到,该反应的离子方程式是Cl2+H2O=H++Cl-+HClO;D为Cl所在周期是第三周期,与其同周期的E元素的单质还原性最强,则E为Na单质,钠与甲是H2O的反应后的溶液是NaOH溶液,呈碱性,用电离方程式表示其原因是:NaOH=Na++OH-。
(3)①A、B、C元素可组成多种化合物。由A、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则丁为乙烯,因乙为甲烷,实验室中可用来除去甲烷中少量乙烯的试剂是①Br2的CCl4溶液。
②A、B、C组成的化合物中有2种化合物,其结构简式分别为:CH3CH2OH和CH3OCH3,化学式均为C2H6O,则这2种化合物的关系互称为同分异构体。为了鉴别这两种化合物,某同学用一小块Na的单质分别投入盛有这2种化合物的试管中,其中能与Na的单质发生反应的化
学反应方程式为2C2H5OH+2Na→2C2H5ONa+H2↑。

 口算能手系列答案
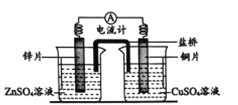
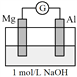
口算能手系列答案【题目】实验小组探究铝片做电极材料时的原电池反应,设计下表中装置进行实验并记录。
【实验1】
装置 | 实验现象 |
| 左侧装置电流计指针向右偏转,灯泡亮 右侧装置电流计指针向右偏转,镁条、铝条表面产生无色气泡 |
(1)实验1中,电解质溶液为盐酸,镁条做原电池的________极。
【实验2】
将实验1中的电解质溶液换为NaOH溶液进行实验2。
(2)该小组同学认为,此时原电池的总反应为2Al + 2NaOH + 2H2O ![]() 2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
实验2实际获得的现象如下:
装置 | 实验现象 |
| i.电流计指针迅速向右偏转,镁条表面无气泡,铝条表面有气泡 ⅱ.电流计指针逐渐向零刻度恢复,经零刻度后继续向左偏转。镁条表面开始时无明显现象,一段时间后有少量气泡逸出,铝条表面持续有气泡逸出 |
(3)i中铝条表面放电的物质是溶解在溶液中的O2,则该电极反应式为________。
(4)ii中“电流计指针逐渐向零刻度恢复”的原因是________。
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
编号 | 装置 | 实验现象 |
实验3 |
| 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约10分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
实验4 |
煮沸冷却后的溶液 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
(5)根据实验3和实验4可获得的正确推论是________ (填字母序号)。
A. 上述两装置中,开始时铜片表面得电子的物质是O2
B. 铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关
C. 铜片表面产生的气泡为H2
D. 由“铝条表面气泡略有减少”能推测H+在铜片表面得电子
(6)由实验1~实验4可推知,铝片做电极材料时的原电池反应与________等因素有关。