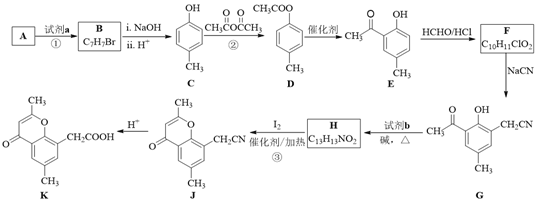
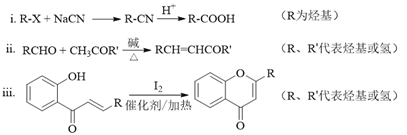题目内容
【题目】下列有关化学研究的正确说法是( )
A. 同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B. 从HF、HCl、HBr、HI酸性递增的事实,推出F、、Cl、Br、I的非金属递增的规律
C. 利用“海水→氢氧化镁→氯化镁→金属镁”的工艺流程生产金属镁
D. 依据丁达尔现象可将分散系分为溶液、胶体与浊液
【答案】C
【解析】A.要研究化学反应速率影响因素时只能改变一个条件;B.卤素元素的非金属性越强,其氢化物的稳定性越强,其氢化物在水溶液中电离程度越小;C.海水加入氢氧化钙沉淀生成氢氧化镁,过滤得到沉淀用盐酸溶解,得到氯化镁溶液,蒸发浓缩,冷却结晶得到氯化镁晶体,失水后电解熔融氯化镁得到金属镁;D.溶液和浊液没有丁达尔效应。
A.要研究化学反应速率影响因素时只能改变一个条件,如果改变两个条件,无法得出规律,故A错误;B.卤素元素的非金属性越强,其氢化物的稳定性越强,氢化物在水溶液中电离程度越小,则相应氢化物的酸性越弱,从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属减弱的规律,故B错误;C.海水加入氢氧化钙沉淀生成氢氧化镁,过滤得到沉淀用盐酸溶解,得到氯化镁溶液,蒸发浓缩,冷却结晶得到氯化镁晶体,失水后电解熔融氯化镁得到金属镁,所以利用“海水![]() 氢氧化镁
氢氧化镁![]() 氯化镁
氯化镁![]() 金属镁”的工艺流程,可以生产金属镁,所以故C正确;D.溶液和浊液没有丁达尔效应,所以根据丁达尔现象不能将分散系分为溶液、胶体与浊液,故D错误;故选C。
金属镁”的工艺流程,可以生产金属镁,所以故C正确;D.溶液和浊液没有丁达尔效应,所以根据丁达尔现象不能将分散系分为溶液、胶体与浊液,故D错误;故选C。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案【题目】
(Ⅰ)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g。
请完成以下实验设计表,并在实验目的一栏中填空:
实验 编号 | 温度 (℃) | 大理石 规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (I)实验①和②探究浓度对反应速率的影响; (II)实验①和③探究温度对反应速率的影响; (III)实验①和④探究______________对反应速率的影响 |
② | 25 | 粗颗粒 | _______ | |
③ | _____ | 粗颗粒 | 2.00 | |
④ | 25 | 细颗粒 | 2.00 |
(Ⅱ)把2.5 mol A和2.5 mol B混合放入2 L密闭容器里,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 s后反应达平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
xC(g)+2D(g),经5 s后反应达平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
(1)达平衡时B的转化率为_____________________。
(2)x的值为___________________。
(3)若温度不变,达平衡时容器内气体的压强是反应前的____________倍。
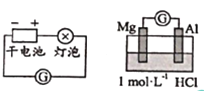
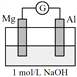
【题目】实验小组探究铝片做电极材料时的原电池反应,设计下表中装置进行实验并记录。
【实验1】
装置 | 实验现象 |
| 左侧装置电流计指针向右偏转,灯泡亮 右侧装置电流计指针向右偏转,镁条、铝条表面产生无色气泡 |
(1)实验1中,电解质溶液为盐酸,镁条做原电池的________极。
【实验2】
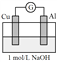
将实验1中的电解质溶液换为NaOH溶液进行实验2。
(2)该小组同学认为,此时原电池的总反应为2Al + 2NaOH + 2H2O ![]() 2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
实验2实际获得的现象如下:
装置 | 实验现象 |
| i.电流计指针迅速向右偏转,镁条表面无气泡,铝条表面有气泡 ⅱ.电流计指针逐渐向零刻度恢复,经零刻度后继续向左偏转。镁条表面开始时无明显现象,一段时间后有少量气泡逸出,铝条表面持续有气泡逸出 |
(3)i中铝条表面放电的物质是溶解在溶液中的O2,则该电极反应式为________。
(4)ii中“电流计指针逐渐向零刻度恢复”的原因是________。
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
编号 | 装置 | 实验现象 |
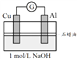
实验3 |
| 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约10分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
实验4 |
煮沸冷却后的溶液 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
(5)根据实验3和实验4可获得的正确推论是________ (填字母序号)。
A. 上述两装置中,开始时铜片表面得电子的物质是O2
B. 铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关
C. 铜片表面产生的气泡为H2
D. 由“铝条表面气泡略有减少”能推测H+在铜片表面得电子
(6)由实验1~实验4可推知,铝片做电极材料时的原电池反应与________等因素有关。