��Ŀ����
����Ŀ����������װ��(�������ظ�ʹ��)�Ʊ�PH3��֤��PH3����ǿ��ԭ�Ժ��Ȳ��ȶ��ԡ���֪: ����״̬ʱPH3��һ����ɫ������ˮ���о綾������,����ǿ��ԭ��,�ڿ���������ȼ; �ڰ���(P4)������Ϊ��ɫ���ɫ��״����,������ˮ,�ڿ���������ȼ;��������һ���ӷ���Һ��,�е�34.6��,���ܽ���ס�
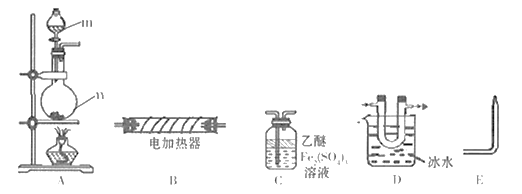
(1)����m������Ϊ_________��װ��C����Ϊ____________��
(2)ʵ�����ð�����NaOHŨ��Һ��Ӧ����NaHPO2��ͬʱ�Ƶ�PH3,��Ӧ�Ļ�ѧ����ʽΪ___________��
(3)��װ��A��ȡPH3��ʵ��ǰ,������n�м������������ѺͰ��ײ��ȣ�Ȼ��ŵ���ŨNaOH��Һ��ʵ��ǰ���ȵ�Ŀ����___________��
(4)��A��C��E��������,����(3)�в�������ŨNaOH��Һ��,ͬʱ��ȼE�����������壬��װ��C����Һ��ɫ��dz,ͬʱ�õ���ɫ��״����,˵��PH3����____��,װ��C�з����Ļ�ѧ��Ӧ����ʽΪ_________����ȼE�������Ŀ��Ϊ______________��
(5)������װ�������֤��PH3�����ѷֽ�,����֤PH3���ȷֽ���������,����������˳��Ϊ
A![]()
![]() D
D![]()
![]() ______
______![]() E( �ڡ�
E( �ڡ�![]() ��֮��Ŀհ״���дװ�ñ��)��
��֮��Ŀհ״���дװ�ñ��)��
��֤��PH3�ֽ����������������_________________��
���𰸡� ��Һ©�� ϴ��ƿ P4+3NaOH +3H2O![]() 3NaH2PO2+ PH3�� �ų�װ���еĿ���,��ֹP4��PH3��ȼ ��ԭ 6Fe2(SO4)3+4PH3 =P4��+12FeSO4+6H2SO4 PH3�ж�,��ֹ��Ⱦ���� B
3NaH2PO2+ PH3�� �ų�װ���еĿ���,��ֹP4��PH3��ȼ ��ԭ 6Fe2(SO4)3+4PH3 =P4��+12FeSO4+6H2SO4 PH3�ж�,��ֹ��Ⱦ���� B![]() D
D![]() C
C![]() C �ڶ�ƿC����Һ����ɫ,��ȼE������.�������ɫ
C �ڶ�ƿC����Һ����ɫ,��ȼE������.�������ɫ
�����������������(1)����װ��ͼ�ش�����m��������װ��C��������(2)���ݵ�ʧ�����غ���ƽ����ʽ��(3). ���ȿ���ʹ���ѻӷ����ų�װ���еĿ�����(4)��װ��C����Һ��ɫ��dz,ͬʱ�õ���ɫ��״������˵���а���������װ��C��Fe2(SO4)3��PH3 ��Ӧ����P4��FeSO4��H2SO4��PH3�ж�,ȼ�տ��Է�ֹ��Ⱦ����(5) PH3���ȷֽ�����������,��PH3����ͨ������ȹ�B��ͨ��װ��D�ռ�������ͨ��C��ȥʣ���PH3���ٴ�ͨ��C֤��PH3������������ͨ��װ��E����ȼ����֤���������ɡ����ڶ�ƿC����Һ����ɫ��˵��PH3�����ѳ�������ȼE���������������ɫ˵����������
������(1)����װ��ͼ������m�������Ƿ�Һ©����װ��C������ϴ��ƿ��(2)������NaOHŨ��Һ��Ӧ����NaHPO2��PH3����Ӧ�Ļ�ѧ����ʽΪP4+3NaOH +3H2O![]() 3NaH2PO2+ PH3����(3).���ȿ���ʹ���ѻӷ����ų�װ���еĿ�������ֹP4��PH3��ȼ��(4)��װ��C����Һ��ɫ��dz,ͬʱ�õ���ɫ��״������˵���а���������˵��PH3���л�ԭ����װ��C��Fe2(SO4)3��PH3 ��Ӧ����P4��FeSO4��H2SO4����Ӧ����ʽ��6Fe2(SO4)3+4PH3 =P4��+12FeSO4+6H2SO4��PH3�ж�,ȼ�տ��Է�ֹ��Ⱦ������(5) PH3���ȷֽ�����������,��PH3����ͨ������ȹ�B��ͨ��װ��D�ռ�������ͨ��C��ȥʣ���PH3���ٴ�ͨ��C֤��PH3������������ͨ��װ��E����ȼ����֤���������ɣ���������������˳����A
3NaH2PO2+ PH3����(3).���ȿ���ʹ���ѻӷ����ų�װ���еĿ�������ֹP4��PH3��ȼ��(4)��װ��C����Һ��ɫ��dz,ͬʱ�õ���ɫ��״������˵���а���������˵��PH3���л�ԭ����װ��C��Fe2(SO4)3��PH3 ��Ӧ����P4��FeSO4��H2SO4����Ӧ����ʽ��6Fe2(SO4)3+4PH3 =P4��+12FeSO4+6H2SO4��PH3�ж�,ȼ�տ��Է�ֹ��Ⱦ������(5) PH3���ȷֽ�����������,��PH3����ͨ������ȹ�B��ͨ��װ��D�ռ�������ͨ��C��ȥʣ���PH3���ٴ�ͨ��C֤��PH3������������ͨ��װ��E����ȼ����֤���������ɣ���������������˳����A![]() B
B![]() D
D![]() C
C![]() C
C ![]() E�����ڶ�ƿC����Һ����ɫ��˵��PH3�����ѳ�������ȼE���������������ɫ˵��������������
E�����ڶ�ƿC����Һ����ɫ��˵��PH3�����ѳ�������ȼE���������������ɫ˵��������������

 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�����Ŀ��
(��)ij̽��С����HNO3�����ʯ��Ӧ������������С�ķ������о�Ӱ�췴Ӧ���ʵ����ء�����HNO3Ũ��Ϊ1.00mol/L��2.00mol/L������ʯ��ϸ�����ʹֿ������ֹ��ʵ���¶�Ϊ25�桢35�棬ÿ��ʵ��HNO3������Ϊ25.00mL������ʯ����Ϊ10.00g��
���������ʵ����Ʊ�������ʵ��Ŀ��һ������գ�
ʵ�� ��� | �¶� ���棩 | ����ʯ ��� | HNO3Ũ�ȣ�mol/L�� | ʵ��Ŀ�� |
�� | 25 | �ֿ��� | 2.00 | (I)ʵ��ٺ͢�̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죻 (II)ʵ��ٺ͢�̽���¶ȶԷ�Ӧ���ʵ�Ӱ�죻 (III)ʵ��ٺ͢�̽��______________�Է�Ӧ���ʵ�Ӱ�� |
�� | 25 | �ֿ��� | _______ | |
�� | _____ | �ֿ��� | 2.00 | |
�� | 25 | ϸ���� | 2.00 |
(��)��2.5 mol A��2.5 mol B��Ϸ���2 L�ܱ������������Ӧ��3A(g)��B(g)![]() xC(g)��2D(g)����5 s��Ӧ��ƽ�⡣�ڴ�5 s��C��ƽ����Ӧ����Ϊ0.2 mol/(L��s)��ͬʱ����1 mol D������
xC(g)��2D(g)����5 s��Ӧ��ƽ�⡣�ڴ�5 s��C��ƽ����Ӧ����Ϊ0.2 mol/(L��s)��ͬʱ����1 mol D������
��1����ƽ��ʱB��ת����Ϊ_____________________��
��2��x��ֵΪ___________________��
��3�����¶Ȳ��䣬��ƽ��ʱ�����������ѹǿ�Ƿ�Ӧǰ��____________����