题目内容
【题目】马日夫盐![]() 用于钢铁制品,特别是大型机械设备的磷化处理,可起到防锈效果。以软锰矿(主要成分为
用于钢铁制品,特别是大型机械设备的磷化处理,可起到防锈效果。以软锰矿(主要成分为![]() 及少量的FeO、
及少量的FeO、![]() 和
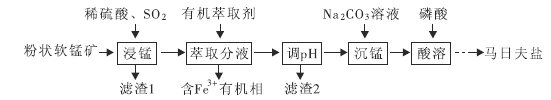
和![]() )为原料制备马日夫盐的主要工艺流程如图:
)为原料制备马日夫盐的主要工艺流程如图:
(1)“浸锰”过程中,FeO参与氧化还原反应的离子方程式为_______________。
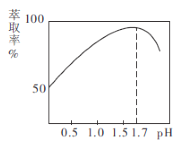
(2)![]() 的萃取率与溶液的pH的关系如图所示,当
的萃取率与溶液的pH的关系如图所示,当![]() 时,
时,![]() 的萃取率急剧下降的原因可能为_______________(用化学用语表示)。
的萃取率急剧下降的原因可能为_______________(用化学用语表示)。
(3)“调pH”的最大范围为________。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| l. 8 | 3.2 |
| 3.0 | 5.0 |
| 5.8 | 8.8 |
| 7.8 | 9.8 |
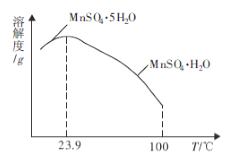
(4)如图为硫酸锰水合物的溶解度曲线,若要用“调pH”所得滤液制备![]() ,需要控制温度在80℃~90℃之间的原因是_____,采用水浴加热,经蒸发浓缩、_____(填操作名称)、用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥获得。
,需要控制温度在80℃~90℃之间的原因是_____,采用水浴加热,经蒸发浓缩、_____(填操作名称)、用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥获得。
(5)写出检验“沉锰”是否已完成的实验操作_________。
(6)常温下,马日夫盐溶液显________性(填“酸”或“碱”),理由是:____________。(写出计算过程并结合必要的文字说明。已知:![]() 的电离常数
的电离常数![]() ,
,![]() ,
,![]() )
)
【答案】2FeO+MnO2+8H+=2Fe3++Mn2++4H2O ![]()
![]() (或5.0~7.8) 温度较高时,有利于析出较多的
(或5.0~7.8) 温度较高时,有利于析出较多的![]() 趁热过滤 取少许上层清液于试管中,滴加
趁热过滤 取少许上层清液于试管中,滴加![]() 溶液,若无沉淀生成,则说明沉锰已经完成 酸性
溶液,若无沉淀生成,则说明沉锰已经完成 酸性 ![]() 水解显酸性:根据
水解显酸性:根据![]() ,
,![]() 的水解常数为
的水解常数为
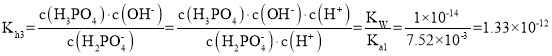
因为![]() 的电离常数
的电离常数![]() 为
为![]() 大于
大于![]() ,所以
,所以![]() 在溶液中以电离为主,即溶液显酸性。
在溶液中以电离为主,即溶液显酸性。
【解析】
软锰矿(主要成分为MnO2,还含有少量的FeO、Al2O3和SiO2)用稀硫酸浸取,FeO、Al2O3和MnO2被溶解,同时二氧化锰氧化Fe2+,多余的二氧化锰被二氧化硫还原为锰离子,反应为2FeO+MnO2+8H+=2Fe3++Mn2++4H2O,SO2+MnO2=SO42-+Mn2+,SiO2不溶,过滤,滤渣1为SiO2,滤液含有:Mn2+、Fe3+、Al3+,加入有机萃取剂,除去Fe3+,调节水层的pH除去Al3+,滤渣2为Al(OH)3,滤液主要含有Mn2+,加入碳酸钠溶液沉锰,得到碳酸锰,再用磷酸反应,净化得到Mn(H2PO4)22H2O,以此来解答。
(1)软锰矿的主要成份为MnO2,结合FeO中铁元素的化合价,可判断FeO被氧化为![]() ,
,![]() 被还原为
被还原为![]() ,反应的离子方程式为:2FeO+MnO2+8H+=2Fe3++Mn2++4H2O,故答案为:2FeO+MnO2+8H+=2Fe3++Mn2++4H2O;
,反应的离子方程式为:2FeO+MnO2+8H+=2Fe3++Mn2++4H2O,故答案为:2FeO+MnO2+8H+=2Fe3++Mn2++4H2O;
(2)因![]() 发生水解,溶液中
发生水解,溶液中![]() 下降,造成萃取率下降,离子方程式为:
下降,造成萃取率下降,离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)从流程来看,前面已经分离出![]() ,调pH的主要目的是为了除去
,调pH的主要目的是为了除去![]() ,同时要防止
,同时要防止![]() 转化为沉淀,所以“调pH”的最大范围为
转化为沉淀,所以“调pH”的最大范围为![]() ,故答案为:
,故答案为:![]() (或5.0~7.8);
(或5.0~7.8);
(4)当温度高于23.9℃时,硫酸锰水合物主要以![]() 形式存在,温度升高其溶解度呈下降趋势,温度在80℃~90℃
形式存在,温度升高其溶解度呈下降趋势,温度在80℃~90℃![]() 的溶解度较小,有利于析出。“趁热过滤”可防止因温度过低而析出
的溶解度较小,有利于析出。“趁热过滤”可防止因温度过低而析出![]() ,而且趁热时
,而且趁热时![]() 溶解度较低,有利于获得更多
溶解度较低,有利于获得更多![]() ,故答案为:温度较高时,有利于析出较多的
,故答案为:温度较高时,有利于析出较多的![]() ;趁热过滤;
;趁热过滤;
(5) “沉锰”完成时,溶液中![]() 很小,再加入
很小,再加入![]() 溶液,难以形成
溶液,难以形成![]() 沉淀,故答案为:取少许上层清液于试管中,滴加
沉淀,故答案为:取少许上层清液于试管中,滴加![]() 溶液,若无沉淀生成,则说明沉锰已经完成;
溶液,若无沉淀生成,则说明沉锰已经完成;
(6)![]() 水解显酸性是造成马日夫盐的水溶液显酸性的原因之一,
水解显酸性是造成马日夫盐的水溶液显酸性的原因之一,![]() 的电离程度与水解程度的大小关系也是影响其酸碱性的另一原因。根据水解方程式
的电离程度与水解程度的大小关系也是影响其酸碱性的另一原因。根据水解方程式![]() ,可知
,可知![]() 的水解常数为
的水解常数为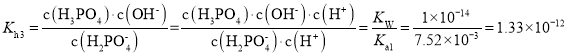 因为
因为![]() 的电离常数为
的电离常数为![]() 大于其水解常数,所以
大于其水解常数,所以![]() 在溶液中以电离为主,即溶液显酸性,故答案为:酸性;
在溶液中以电离为主,即溶液显酸性,故答案为:酸性;![]() 水解显酸性:根据
水解显酸性:根据![]() ,
,![]() 的水解常数为
的水解常数为
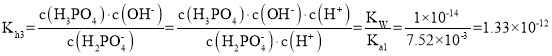
因为![]() 的电离常数
的电离常数![]() 为
为![]() 大于
大于![]() ,所以
,所以![]() 在溶液中以电离为主,即溶液显酸性。
在溶液中以电离为主,即溶液显酸性。