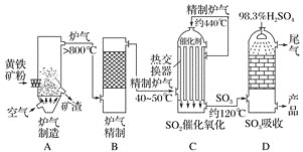
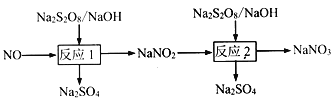
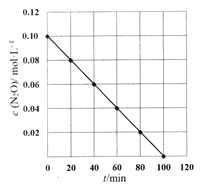
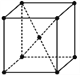
题目内容
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+离子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)E元素基态原子的电子排布式为________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为________(填元素符号),其原因是________________________________________________________________________。
(3)D元素与氟元素相比,电负性:D________(填“>”“=”或“<”)F,下列表述中能证明这一事实的是______(填选项序号)。
A.常温下氟气的颜色比D单质的颜色深 B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态 D.比较两元素的单质与氢气化合时得电子的数目
(4)由A、C两元素可形成化合物CA5含有的化学键类型为________。
(5)B2A4是重要的石油化工原料,B2A4的结构式为________。B2A4通过聚合反应可以生成一种有机高分子化合物,反应方程式为________。
【答案】 1s22s22p63s23p63d104s1 C、O、N 同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势。但氮元素的外层电子达到半充满的稳定构型,其第一电离能大于氧元素 < BC 离子键,共价键 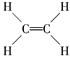 nCH2===CH2
nCH2===CH2![]()
![]()
【解析】A原子所处的周期数、族序数都与其原子序数相等,A为H元素;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍,B为C元素;D原子L层上有2对成对电子,其排布为1s22s22p4,D为O元素;C介于C、O之间,为N元素;E+离子核外有3层电子且M层3d轨道电子全充满,E原子核外电子数为2+8+18+1=29,E为Cu元素。
(1) Cu原子的原子序数为29,其基态原子的电子排布式为1s22s22p63s23p63d104s1 ;正确答案:1s22s22p63s23p63d104s1。
(2) 同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势。但氮元素的外层电子达到半充满的稳定构型,其第一电离能大于氧元素;所以 C、N、O三种元素的第一电离能数值由小到大的顺序为C、O、N ;正确答案:C、O、N;同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势。但氮元素的外层电子达到半充满的稳定构型,其第一电离能大于氧元素。
(3) O元素与氟元素相比,电负性O < F;电负性为元素的化学性质,而气体的颜色为物理性质,没有可比性,A错误;氟气与水剧烈反应,产生氧气,氟气置换氧气,说明F的非金属性大于O,电负性较大,B正确;F与O形成的化合物中O元素呈正价态,说明F的非金属性大于O的非金属性,电负性F大,C正确; F2与氢气冷暗处发生爆炸,O2与氢气点燃才能发生反应,说明非金属性氟最大,不能看两元素的单质与氢气化合时得电子的数目的多少,而是看得电子的能力,D错误;正确选项BC。
(4)由H、N两元素可形成化合物NH5,它是由铵根离子和氢负离子构成的化合物,既含有离子键,又含有共价键;正确答案:离子键,共价键。
(5) C2H4是重要的石油化工原料,它是最简单的烯烃,含有碳碳双键,其结构式为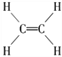 ;乙烯在一定条件下发生加聚反应生成聚乙烯高分子,反应方程式为nCH2===CH2
;乙烯在一定条件下发生加聚反应生成聚乙烯高分子,反应方程式为nCH2===CH2![]()
![]() ;正确答案:
;正确答案: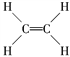 ; nCH2===CH2
; nCH2===CH2![]()
![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案