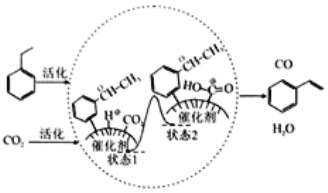
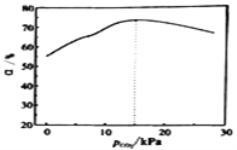
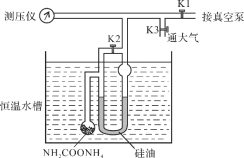
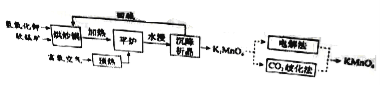
��Ŀ����
����Ŀ�������£���10 mL 0.1 mol��L��1 NaA��Һ��μ���10 mL 0.1 mol��L��1 HA��Һ�У���֪HA�ĵ���ƽ�ⳣ��Ka = 1.8��10��4������˵����ȷ����
A.�μӹ����У������Һ��![]() ʼ�ձ�С
ʼ�ձ�С
B.�μӹ����У������Һ��c(H+) + c(OH��) > 2.0��10��7 mol��L��1
C.��ֻ�Ϻ���Һ��A����ˮ��̶ȱ�ԭNaA��Һ��A����ˮ��̶ȴ�
D.��ֻ�Ϻ���Һ��c(Na+) > c(A��) > c(HA) > c(H+) > c(OH��)
���𰸡�B
��������
A. ![]() ���μӹ����У�������Ũ�ȼ�С��������Һ��
���μӹ����У�������Ũ�ȼ�С��������Һ��![]() ʼ�ձ��A����
ʼ�ձ��A����
B. Ka = 1.8��10��4����HA�ĵ������A-ˮ�⣬�μӹ����У������Һ�����ԣ���ˮ�����Ӽ�![]() ����
����![]() ����B��ȷ��
����B��ȷ��
C. ��ֻ�Ϻ���ҺΪNaA��HA�Ļ��Һ��HA��Һ����A����ˮ�⣬��C����
D. ��ֻ�Ϻ���ҺΪNaA��HA�Ļ��Һ����HA�ĵ������A-ˮ�⣬����Һ��c(A��)��c(Na+)��c(HA)��c(H+)��c(OH��)����D����
�ʴ�ѡ��B��

��ϰ��ϵ�д�
 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ����ʦ����ѧ������ϵ�д�
ͬ����ϰ����ʦ����ѧ������ϵ�д�
�����Ŀ