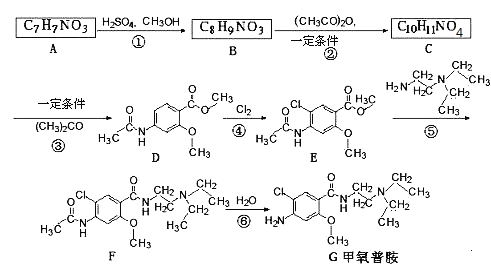
题目内容
【题目】醋酸是常见的弱酸,氨水是常见的弱碱。
(1)25℃时,用0.1000mol·L-1盐酸滴定25.00mL0.1000mol·L-1氨水的滴定曲线如图所示。
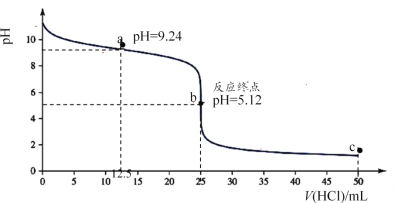
①滴定时,可选用____(填“甲基橙”或“酚酞”)作指示剂; 锥形瓶中水的电离程度:a点____b点(填“>”“<”或“=”)。
②滴定至反应终点前,溶液中发生反应的离子方程式为____。
③滴定至a点处,锥形瓶中NH4+ 、Cl-、NH3·H2O的浓度由小到大的顺序为____。
④滴定至c点处,锥形瓶中NH4+ 、Cl-、H+的浓度由小到大的顺序为____。
(2)25℃时,用HCl或NaOH调节醋酸的pH,配得一组c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1溶液,溶液中H+、OH-、CH3COO-及CH3COOH浓度的对数值(lgc)与pH关系如图所示:
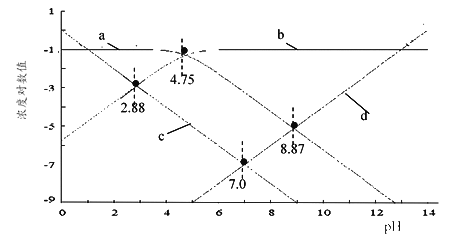
①图中表示H+的线是____(填小写字母);0.1 mol·L-1CH3COONa溶液的pH约为____(保留2位小数)。
②反应CH3COOH![]() CH3COO-+ H+的电离常数的对数值lgK=____(填数值)。
CH3COO-+ H+的电离常数的对数值lgK=____(填数值)。
【答案】 甲基橙 < NH3·H2O + H+= NH4++ H2O c(NH3·H2O) <c(Cl-) <c(NH4+) c(NH4+) <c(H+)<c(Cl-) c 8.87 -4.75
【解析】(1)①强酸滴定弱碱时滴定终点溶液呈酸性,故滴定时可选用甲基橙作指示剂;a点滴入盐酸物质的量为氨水的一半,溶液呈碱性抑制水的电离,b点达到滴定终点为氯化铵溶液,氯化铵水解促进水的电离,故锥形瓶中水的电离程度:a点<b点;②滴定至反应终点前,溶液中仍发生盐酸与氨水反应,故发生反应的离子方程式为NH3·H2O + H+= NH4++ H2O;③滴定至a点处,锥形瓶中为以按氨水和氯化铵1:1形成的溶液且溶液呈碱性,说明氨水的电离大于铵根离子的水解,故NH4+ 、Cl-、NH3·H2O的浓度由小到大的顺序为c(NH3·H2O) <c(Cl-) <c(NH4+);④滴定至c点处,锥形瓶中为以按盐酸和氯化铵1:1形成的溶液且溶液呈酸性,铵根离子的水解故离子浓度小于氯离子,锥形瓶中NH4+ 、Cl-、H+的浓度由小到大的顺序为c(NH4+) <c(H+)<c(Cl-);(2)①pH=0时lgc=0,pH=7时lgc=7,故图中表示H+的线是c;故d表示OH-的线,b表示CH3COOH的线,a表示CH3COO-的线,故0.1 mol·L-1CH3COONa溶液的pH约为8.87;②pH=4.75时,c(CH3COO-)=c(CH3COOH),K= c(H+),反应CH3COOH![]() CH3COO-+ H+的电离常数的对数值lgK=lg c(H+)=-4.75。
CH3COO-+ H+的电离常数的对数值lgK=lg c(H+)=-4.75。