题目内容
【题目】相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气; ②若不使用催化剂,加热至470 ℃左右,得到KClO4(高氯酸钾)和KCl。下列关于①和②的说法不正确的是
A. 都是氧化还原反应 B. 发生还原反应的元素相同
C. 发生氧化反应的元素不同 D. 生成KCl的物质的量相同
【答案】D
【解析】试题分析:①发生2KClO3![]() 2KCl+3O2↑,Cl元素的化合价降低,O元素的化合价升高;②发生4KClO3
2KCl+3O2↑,Cl元素的化合价降低,O元素的化合价升高;②发生4KClO3 ![]() 3KClO4 + KCl,Cl元素的化合价既升高又降低。A.两个反应中均有元素的化合价变化,都属于氧化还原反应,故A正确;B.两个反应中均有Cl元素的化合价降低,则发生还原反应的元素相同,故B正确;C.①中O元素发生氧化反应,②中Cl元素发生氧化反应,故C正确;D.均4mol时,①生成4molKCl,②生成1molKCl,生成KCl的物质的量不同,故D错误;故选D。
3KClO4 + KCl,Cl元素的化合价既升高又降低。A.两个反应中均有元素的化合价变化,都属于氧化还原反应,故A正确;B.两个反应中均有Cl元素的化合价降低,则发生还原反应的元素相同,故B正确;C.①中O元素发生氧化反应,②中Cl元素发生氧化反应,故C正确;D.均4mol时,①生成4molKCl,②生成1molKCl,生成KCl的物质的量不同,故D错误;故选D。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案【题目】以工业废铁屑为原料生产氧化铁红颜料并进行适当的综合利用,其主要流程如图: 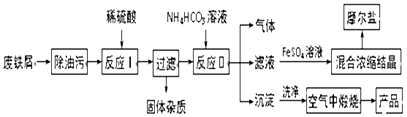
已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液.
(1)写出在空气中煅烧沉淀的化学反应方程式: .
(2)本流程中产生的CO2和H2 , 在催化剂作用下按体积比1:1合成一种重要的有机化工原料R,该合成符合绿色化学要求.已知液体R的燃烧热为254.6 kJ/mol,则R完全燃烧的热化学方程式为
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4FeSO46H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4FeSO46H2O粗产品,下列方法中最合适的是
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c molL﹣1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如表:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
KMnO4溶液应盛装在滴定管中,滴定过程中发生反应的离子方程式为滴定终点的现象是通过实验数据计算的该产品纯度为(用字母ac表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.