��Ŀ����
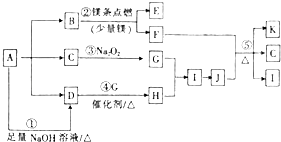
����Ŀ����A��B��C��D��E���ֳ���������������±��е������γɵģ�
������ | K+��Na+ ��Cu2+�� Al3+ |
������ | SO |
Ϊ�˼�������������ֱ��������ʵ�飬�����ǣ�
�ٽ���������ˮ��DΪ��ɫ��Һ��������Ϊ��ɫ��Һ��
�ڽ�E��Һ���뵽C��Һ�г��ְ�ɫ�����������μӣ������ܽ⣻
�۽�����ɫ��Ӧ������BΪ��ɫ������ɫ�ܲ�������
���ڸ���Һ�м��������ữ�����ᱵ��Һ��ֻ��A�зų���ɫ���壬ֻ��D�в�����ɫ������
�ݽ�B��C����Һ��ϣ�δ���������������ɣ���������ʵ����գ�
��1��д��B��D�Ļ�ѧʽ��B �� D ��
��2��C��������ˮ���������ӷ���ʽ��ʾ�侻ˮԭ�� ��
��3������0.01mol A����Һ�뺬0.02mol E����Һ��Ӧ������Һ�еμ�0.1molL��1ϡ���ᣮ����ͼ������ȷ��ʾ������������������CO2�����ʵ����Ĺ�ϵ����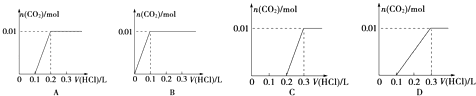
��4����mmL b molL��1 C��Һ�У���������a molL��1 ��E��Һ����a��3bʱ�����ɳ��������ʵ����� mol����3b��a��4b��ʱ�����ɳ��������ʵ����� mol��
���𰸡�
��1��KCl��CuSO4
��2��Al3++3H2O?Al��OH��3�����壩+3H+
��3��C
��4��![]()
��10��3����4mb��ma����10��3
���������⣺�ٽ���������ˮ��DΪ��ɫ��Һ��������Ϊ��ɫ��Һ����D�к���Cu2+���ڽ�E��Һ���뵽C��Һ�У����ְ�ɫ�����������μӳ����ܽ⣬��C�к���Al3+ �� E�к���OH�� ���ӣ��۽�����ɫ��Ӧʵ�飬ֻ��B����K+���ӣ���Ϣڿ�֪E��NaOH�����ڸ���Һ�м���Ba��NO3��2��Һ���ټ������ϡ���ᣬA�зų���ɫ���壬��A�к���HCO ![]() ���ӣ�D�в�����ɫ��������D�к���SO42�����ӣ�����D��CuSO4 �� C��AlCl3���ݽ�B��C����Һ��ϣ�δ���������������ɣ���B��KCl������A��NaHCO3 �� ��1��������������֪��B��D�ֱ��ǣ�KCl��CuSO4 �� ���Դ��ǣ�KCl��CuSO4����2��CΪ�Ȼ�����ˮ�����ɽ���ɾ���ˮ�����ӷ�ӦΪAl3++3H2OAl��OH��3�����壩+3H+ �� ���Դ��ǣ�Al3++3H2OAl��OH��3�����壩+3H+����3��������ӦNaHCO3+NaOH=Na2CO3+H2O����Ӧ��ʣ��0.01molNaOH������0.01molNa2CO3 �� �ٵμ����ᣬ���ȷ�����ӦNaOH+HCl=NaCl+H2O���ٷ���HCl+Na2CO3=NaHCO3+NaCl����ʼû������ų�������������
���ӣ�D�в�����ɫ��������D�к���SO42�����ӣ�����D��CuSO4 �� C��AlCl3���ݽ�B��C����Һ��ϣ�δ���������������ɣ���B��KCl������A��NaHCO3 �� ��1��������������֪��B��D�ֱ��ǣ�KCl��CuSO4 �� ���Դ��ǣ�KCl��CuSO4����2��CΪ�Ȼ�����ˮ�����ɽ���ɾ���ˮ�����ӷ�ӦΪAl3++3H2OAl��OH��3�����壩+3H+ �� ���Դ��ǣ�Al3++3H2OAl��OH��3�����壩+3H+����3��������ӦNaHCO3+NaOH=Na2CO3+H2O����Ӧ��ʣ��0.01molNaOH������0.01molNa2CO3 �� �ٵμ����ᣬ���ȷ�����ӦNaOH+HCl=NaCl+H2O���ٷ���HCl+Na2CO3=NaHCO3+NaCl����ʼû������ų������������� ![]() =0.2L�������μ�����ʱ��������Ӧ��NaHCO3+HCl=NaCl+H2O+CO2��������0.01mol���壬����������Ϊ
=0.2L�������μ�����ʱ��������Ӧ��NaHCO3+HCl=NaCl+H2O+CO2��������0.01mol���壬����������Ϊ ![]() =0.1L������������0.3L��ѡ����ͼ��C���ϣ���ѡ��C����4����m mL b molL��1 AlCl3��Һ�У���������a molL��1 ��NaOH��Һ����a��3bʱ����㣬����Al3++3OH���TAl��OH��3�������ɳ��������ʵ�����m��10��3L��amol/L��
=0.1L������������0.3L��ѡ����ͼ��C���ϣ���ѡ��C����4����m mL b molL��1 AlCl3��Һ�У���������a molL��1 ��NaOH��Һ����a��3bʱ����㣬����Al3++3OH���TAl��OH��3�������ɳ��������ʵ�����m��10��3L��amol/L�� ![]() =
= ![]() ��10��3mol����3b��a��4bʱ����Al3++3OH���TAl��OH��3�������ɳ���Ϊmb��10��3mol������NaOHΪ3mb��10��3mol��Ȼ����Al��OH��3+OH���TAlO
��10��3mol����3b��a��4bʱ����Al3++3OH���TAl��OH��3�������ɳ���Ϊmb��10��3mol������NaOHΪ3mb��10��3mol��Ȼ����Al��OH��3+OH���TAlO ![]() +2H2O������Al��OH��3+OH���TAlO
+2H2O������Al��OH��3+OH���TAlO ![]() +2H2O��֪�ܽ�ij���Ϊam��10��3mol��3b��10��3mol��������ɵij���Ϊmb��10��3mol����am��10��3mol��3b��10��3mol��=��4mb��mama����10��3mol�����Դ��ǣ�
+2H2O��֪�ܽ�ij���Ϊam��10��3mol��3b��10��3mol��������ɵij���Ϊmb��10��3mol����am��10��3mol��3b��10��3mol��=��4mb��mama����10��3mol�����Դ��ǣ� ![]() ��10��3����4mb��ma����10��3 ��
��10��3����4mb��ma����10��3 ��

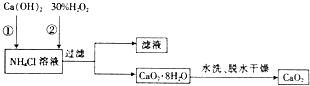
����Ŀ���ڻ�ƿ�м��롰�ʻ����ʼ��������ӳ��ʻ����������±���500mL���ʻ����ʼ����к��еijɷ֣��Ķ���ش��������⣺
�ɷ� | ������g�� | Ħ��������gmol��1�� |
���� | 25.00 | 342 |
����� | 3.48 | 174 |
��˾ƥ�� | 0.17 | 180 |
������� | 1.58 | 158 |
������ | 0.02 | 170 |
��1�����С��ʻ����ʼ����ijɷ��У����ڵ���ʵ��� ��
A.����
B.�����
C.�������
D.������
��2�����ʻ����ʼ�����K+����˾ƥ���в���K+�������ʵ���Ũ��Ϊ ��
��3�������������ʻ����ʼ����õ��IJ�����������Ͳ�����������ձ�����ȱ�� �� ����д��ȱ���������ƣ���
��4��������Һʱ�����¼������������ܽ� ��ҡ�� ��ϴ�� ����ȴ �ݳ��� ��ת����Һ �߶��ݣ�
��ȷ�IJ���˳����������ţ���
��5��������ʱ��������ƿ�̶��ߣ���ʹ������ҺŨ������ƫ��ƫС�����䣩��