题目内容
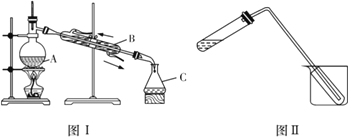
【题目】某研究性学习小组设计实验用30mL浓硫酸与10mL无水乙醇共热制备乙烯气体、并测定乙醇转化成乙烯的转化率。已知生成的乙烯气体中含有SO2、CO2、乙醇和乙醚等杂质。有关数据如下:
熔点/℃ | 沸点/℃ | 溶解性 | 颜色状态 | 密度g/cm3 | |
乙醇 | -114.1 | 78.3 | 与水、有机溶剂互溶 | 无色液体 | 0.79 |
乙醚 | -116.2 | 34.5 | 不溶于水,易溶于有机溶剂 | 无色液体 | 0.7135 |
(1)制备乙烯
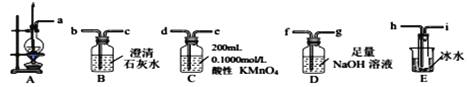
① 从A~E中选择必要的装置完成实验,并按气流方向连接的顺序为________(填仪器接口的字母编号)。
② D装置中发生反应的离子方程式______实验后,检验D溶液中含有CO32-的实验方案为_____。
③ E装置的主要作用是__________________。
(2)测定乙烯反应结束后,用移液管移取C中溶液20mL(不考虑溶液体积变化)于锥形瓶中,先加入约2mL稀硫酸酸化.再用0.1000mol/L的Na2C2O4溶液滴定未反应完的KMnO4。
已知:C2H4 ![]() CO2+H2O;C2O42-
CO2+H2O;C2O42- ![]() CO2+H2O;MnO4-→Mn2+
CO2+H2O;MnO4-→Mn2+
④ 以下情况使得测定乙烯的量偏高的是______
A.在用蒸馏水清洗碱式滴定管后,直接装Na2C2O4标准液
B.锥形瓶清洗干净后残有大量水珠
C.滴定前,滴定管内无气泡,滴定后有气泡
D.读数时,滴定前平视,滴定后俯视
⑤ 滴定终点的现象为_______________。
⑥ 已知用去Na2C2O4溶液20.00mL,则乙醇转化成乙烯的转化率为_________。(小数点后保留2位数字)
【答案】 (1) a→h→i→→fg→d (2)SO2 + 2OH—=SO32— + H2O 、CO2 + 2OH—=CO32— + H2O (3)取少许D溶液于试管中,先滴加足量的双氧水,然后再加入一定量的硫酸,产生能使澄清石灰水浑浊的气体,则证明D溶液中含有CO32— (4)冷凝并收集乙醚 (5)CD (6)溶液由粉红色变成无色,且半分钟内不变色 (7)2.94%
【解析】(1)①用30mL浓硫酸与10mL无水乙醇共热制备乙烯气体、并测定乙醇转化成乙烯的转化率,装置A制备乙烯,已知生成的乙烯气体中含有SO2、CO2、乙醇和乙醚等杂质,通过装置E冷凝乙醇、乙醚,通过装置D中氢氧化钠溶液吸收二氧化硫和二氧化碳,通过装置C中高锰酸钾溶液吸收乙烯测定质量变化来计算乙醇转化率,从A~E中选择必要的装置完成实验,并按气流方向连接的顺序为a→h i→f g→d,故答案为:a→hi→fg→d;
②D装置中发生反应是二氧化硫、二氧化碳和氢氧化钠溶液反应生成碳酸钠、亚硫酸钠和水,反应的离子方程式为:SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O,检验D溶液中含有CO32-的实验方案先加入过氧化氢氧化亚硫酸钠为硫酸钠,再加入硫酸,把生成的气体通入澄清石灰水产生能使澄清石灰水浑浊的气体,则证明D溶液中含有CO32-,故答案为:SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O;取少许D溶液于试管中,先滴加足量的双氧水,然后再加入一定量的硫酸,产生能使澄清石灰水浑浊的气体,则证明D溶液中含有CO32;
③E装置的主要作用是:冷凝并收集乙醚,故答案为:冷凝并收集乙醚;
(2)④A.在用蒸馏水清洗碱式滴定管后,直接装Na2C2O4标准液稀释,溶液浓度减小,消耗标准溶液增大,测定未反应的高锰酸钾增多,与乙烯反应的量减小,计算得到乙醇转化率减小,故A错误;B.锥形瓶清洗干净后残有大量水珠对滴定过程无影响,测定结果不影响,故B错误;C.滴定前,滴定管内无气泡,滴定后有气泡,标准溶液体积读取偏小,计算得到未服药的高锰酸钾减小,则与乙烯反应的高锰酸钾增大,计算得到乙烯物质的量增大,乙醇转化率增大,故C正确;D.读数时,滴定前平视,滴定后俯视,标准溶液体积读取偏小,计算得到未服药的高锰酸钾减小,则与乙烯反应的高锰酸钾增大,计算得到乙烯物质的量增大,乙醇转化率增大,故D正确;故答案为:CD;
⑤再用0.1000mol/L的Na2C2O4溶液滴定未反应完的KMnO4,利用高锰酸钾溶液紫红色来指示反应终点,滴入最后一滴草酸钠溶液紫红色褪去且半分钟不变说明反应达到终点,故答案为:溶液由粉红色变成无色,且半分钟内不变色;
⑥高锰酸钾物质的量为0.2L×0.1000mol/L=0.02mol,被草酸钠滴定反应去的高锰酸钾物质的量结合由反应定量关系计算,
2MnO4- + 5C2C42-+16H+=2Mn2++10CO2↑+8H2O
2 5
n0.1000mol/L×0.020L
n=0.0008mol,与乙烯反应的高锰酸钾物质的量=0.02mol-0.0008mol×![]() =0.012mol,5C2H4+12KMnO4+18H2O=12MnSO4+6K2SO4+10CO2↑+28H2O,CH3CH2OH
=0.012mol,5C2H4+12KMnO4+18H2O=12MnSO4+6K2SO4+10CO2↑+28H2O,CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
5CH3CH2OH~5CH2=CH2~12KMnO4,
512
n(CH3CH2OH)0.012mol
n(CH3CH2OH)=0.005mol,10mL无水乙醇物质的量=![]() =0.17mol,乙醇转化率=
=0.17mol,乙醇转化率=![]() ×100%=2.94%,故答案为:2.94%。
×100%=2.94%,故答案为:2.94%。

 53随堂测系列答案
53随堂测系列答案