题目内容
【题目】一种充电电池放电时的电极反应为:H2+2OH--2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-当为电池充电时,与外电源正极连接的电极上发生的反应是 ( )
A. Ni(OH)2的氧化 B. NiO(OH)的还原 C. H2的氧化 D. H2O的还原
【答案】A
【解析】电池充电时,电池的正极接电源的正极,电池的负极接电源的负极,电池充电时,电极反应式是电池放电时电极反应式的逆过程,即Ni(OH)2被氧化,H2O被还原,故选项A正确。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案【题目】下列物质分类的正确组合是
分类组合 | 纯净物 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | 碱石灰 | 烧碱 | 氧化铝 | 二氧化碳 |
B | NH3H2O | 小苏打 | 氧化镁 | 二氧化氮 |
C | 五水硫酸铜 | 纯碱 | 氧化钠 | 三氧化硫 |
D | H2O2 | 苏打 | 过氧化钠 | 二氧化硫 |
A. A B. B C. C D. D
【题目】某研究性学习小组设计实验用30mL浓硫酸与10mL无水乙醇共热制备乙烯气体、并测定乙醇转化成乙烯的转化率。已知生成的乙烯气体中含有SO2、CO2、乙醇和乙醚等杂质。有关数据如下:
熔点/℃ | 沸点/℃ | 溶解性 | 颜色状态 | 密度g/cm3 | |
乙醇 | -114.1 | 78.3 | 与水、有机溶剂互溶 | 无色液体 | 0.79 |
乙醚 | -116.2 | 34.5 | 不溶于水,易溶于有机溶剂 | 无色液体 | 0.7135 |
(1)制备乙烯
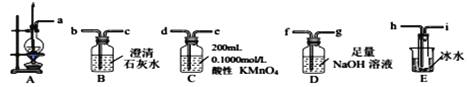
① 从A~E中选择必要的装置完成实验,并按气流方向连接的顺序为________(填仪器接口的字母编号)。
② D装置中发生反应的离子方程式______实验后,检验D溶液中含有CO32-的实验方案为_____。
③ E装置的主要作用是__________________。
(2)测定乙烯反应结束后,用移液管移取C中溶液20mL(不考虑溶液体积变化)于锥形瓶中,先加入约2mL稀硫酸酸化.再用0.1000mol/L的Na2C2O4溶液滴定未反应完的KMnO4。
已知:C2H4 ![]() CO2+H2O;C2O42-
CO2+H2O;C2O42- ![]() CO2+H2O;MnO4-→Mn2+
CO2+H2O;MnO4-→Mn2+
④ 以下情况使得测定乙烯的量偏高的是______
A.在用蒸馏水清洗碱式滴定管后,直接装Na2C2O4标准液
B.锥形瓶清洗干净后残有大量水珠
C.滴定前,滴定管内无气泡,滴定后有气泡
D.读数时,滴定前平视,滴定后俯视
⑤ 滴定终点的现象为_______________。
⑥ 已知用去Na2C2O4溶液20.00mL,则乙醇转化成乙烯的转化率为_________。(小数点后保留2位数字)