题目内容
【题目】三盐(3PbO·PbSO4·H2O,相对分子质量为990)可用作聚氯乙烯的热稳定剂, 不溶于水。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。

已知:Ksp(PbSO4)=1.82×l0-8;Ksp(PbCO3)=l.46×l0-13。
回答下列问题:
(1)加Na2CO3溶液转化的目的是_________.
(2)酸溶时,不直接使用H2SO4溶液的原因可能是________;铅与硝酸在酸溶过程中发生反应的离子方程式为__________.
(3)流程中可循环利用的物质是_________;洗涤操作时,检验沉淀是否洗涤干净的方法是________。
(4)当沉淀转化达平衡时,滤液l中c(SO42-)与c(CO32-)的比值为_____________。
(5) 50-60℃时合成三盐的化学方程式为______;若得到纯净干燥的三盐99.0t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为_________。
【答案】 将PbSO4转化为PbCO3提高铅的利用率 生成的PbSO4为难溶物,阻碍反应持续进行 3Pb+8H++NO3-=3Pb2++2NO↑+4H2O HNO3 取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤干净 1.25×105 4PbSO4+6NaOH![]() 3Na2SO4+3PbO·PbSO4·H2O+2H2O 51.7%
3Na2SO4+3PbO·PbSO4·H2O+2H2O 51.7%
【解析】(1)硫酸铅在溶液中存在溶解平衡,由于碳酸铅的溶解度小于硫酸铅,所以向硫酸铅溶液在加入碳酸铅后发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq),将铅膏中的硫酸铅转化为碳酸铅,加Na2CO3溶液转化的目的是将PbSO4转化为PbCO3提高铅的利用率;(2)酸溶时,不直接使用H2SO4溶液的原因可能是生成的PbSO4为难溶物,阻碍反应持续进行;铅与硝酸在酸溶过程中发生反应的离子方程式为3Pb+8H++NO3-=3Pb2++2NO↑+4H2O;(3)分析流程可知,PbO和PbCO3在硝酸的作用下转化成Pb(NO3),Pb(NO3)中加稀H2SO4转化成PbSO4和硝酸,因此X为HNO3,可循环利用,故答案为:硝酸;洗涤操作时,洗涤液中有SO42―, 检验沉淀是否洗涤干净的方法是: 取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤干净;(4)当沉淀转化达平衡时,滤液l中c(SO42-)与c(CO32-)的比值为
PbCO3(s)+SO42-(aq),将铅膏中的硫酸铅转化为碳酸铅,加Na2CO3溶液转化的目的是将PbSO4转化为PbCO3提高铅的利用率;(2)酸溶时,不直接使用H2SO4溶液的原因可能是生成的PbSO4为难溶物,阻碍反应持续进行;铅与硝酸在酸溶过程中发生反应的离子方程式为3Pb+8H++NO3-=3Pb2++2NO↑+4H2O;(3)分析流程可知,PbO和PbCO3在硝酸的作用下转化成Pb(NO3),Pb(NO3)中加稀H2SO4转化成PbSO4和硝酸,因此X为HNO3,可循环利用,故答案为:硝酸;洗涤操作时,洗涤液中有SO42―, 检验沉淀是否洗涤干净的方法是: 取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤干净;(4)当沉淀转化达平衡时,滤液l中c(SO42-)与c(CO32-)的比值为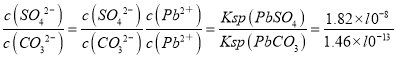 =1.25×105;(5) 50-60℃时合成三盐的化学方程式为4PbSO4+6NaOH
=1.25×105;(5) 50-60℃时合成三盐的化学方程式为4PbSO4+6NaOH![]() 3Na2SO4+3PbO·PbSO4·H2O+2H2O;若得到纯净干燥的三盐99.0t,则其中铅元素的质量为:828/990×99.0t=82.8t,设铅泥中铅的质量分数为W,则200.0t铅泥中铅元素为200W,铅泥中的铅元素有80%转化为三盐,有200W×80%=82.8,则铅泥中铅元素的质量分数为W=51.7%。
3Na2SO4+3PbO·PbSO4·H2O+2H2O;若得到纯净干燥的三盐99.0t,则其中铅元素的质量为:828/990×99.0t=82.8t,设铅泥中铅的质量分数为W,则200.0t铅泥中铅元素为200W,铅泥中的铅元素有80%转化为三盐,有200W×80%=82.8,则铅泥中铅元素的质量分数为W=51.7%。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】某研究性学习小组设计实验用30mL浓硫酸与10mL无水乙醇共热制备乙烯气体、并测定乙醇转化成乙烯的转化率。已知生成的乙烯气体中含有SO2、CO2、乙醇和乙醚等杂质。有关数据如下:
熔点/℃ | 沸点/℃ | 溶解性 | 颜色状态 | 密度g/cm3 | |
乙醇 | -114.1 | 78.3 | 与水、有机溶剂互溶 | 无色液体 | 0.79 |
乙醚 | -116.2 | 34.5 | 不溶于水,易溶于有机溶剂 | 无色液体 | 0.7135 |
(1)制备乙烯
① 从A~E中选择必要的装置完成实验,并按气流方向连接的顺序为________(填仪器接口的字母编号)。
② D装置中发生反应的离子方程式______实验后,检验D溶液中含有CO32-的实验方案为_____。
③ E装置的主要作用是__________________。
(2)测定乙烯反应结束后,用移液管移取C中溶液20mL(不考虑溶液体积变化)于锥形瓶中,先加入约2mL稀硫酸酸化.再用0.1000mol/L的Na2C2O4溶液滴定未反应完的KMnO4。
已知:C2H4 ![]() CO2+H2O;C2O42-
CO2+H2O;C2O42- ![]() CO2+H2O;MnO4-→Mn2+
CO2+H2O;MnO4-→Mn2+
④ 以下情况使得测定乙烯的量偏高的是______
A.在用蒸馏水清洗碱式滴定管后,直接装Na2C2O4标准液
B.锥形瓶清洗干净后残有大量水珠
C.滴定前,滴定管内无气泡,滴定后有气泡
D.读数时,滴定前平视,滴定后俯视
⑤ 滴定终点的现象为_______________。
⑥ 已知用去Na2C2O4溶液20.00mL,则乙醇转化成乙烯的转化率为_________。(小数点后保留2位数字)
【题目】实验室欲配制1mol/L NaOH溶液240ml,请回答:
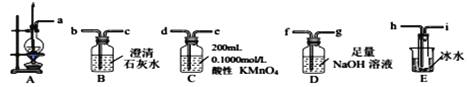
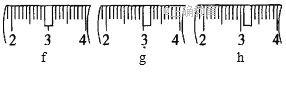
(1)需称取NaOH固体____________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小___________(填字母),并在下图中选出能正确表示游码位置的选项____________(填字母)。
附表砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
(2)选用的主要玻璃仪器除烧杯、玻璃棒外还有_____________________________。
(3)下列操作的顺序是(用序号表示)_________________。
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)下列情况对所配制的NaOH溶液浓度有何影响?(用“偏大”“偏小”“无影响”填写)
①容量瓶用蒸馏洗涤后残留有少量的水________________
②将热的溶液直接移入了容量瓶________________
③定容时,仰视容量瓶的刻度线________________
④转移溶液时,玻璃棒的下端在容量瓶的刻度线以上________________